
|
将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应.下列叙述不正确的是 | |
| [ ] | |
A. |
生成的乙酸乙酯中含有18O |
B. |
生成的水分子中含有18O |
C. |
可能生成44 g乙酸乙酯 |
D. |
不可能生成88 g乙酸乙酯 |
科目:高中化学 来源: 题型:阅读理解

| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | C-C | C-H | H-H | S-H | S-S | S-C |
| 键能/kJ.mol-1 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
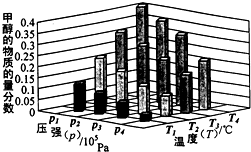 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源:09—10年海南中学高一下学期期末考试化学卷 题型:实验题
(6分)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: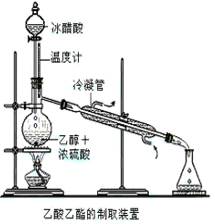
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的_____________。
(2)配制乙醇和浓硫酸的混合液的方法是:先在烧瓶中加入一定量的 ,然后慢慢将 加入烧瓶,边加边振荡。
(3)在该实验中,若用1 mol乙醇和1 mol 乙酸在浓硫
作用下加热,充分反应,不能生成1 mol乙酸乙酯的原因是
。
(4)锥形瓶中得到乙酸、乙醇和水的乙酸乙酯的混合物,欲得到乙酸乙酯并闻到它的气味,需将混合液用 溶液处理,用
(填仪器)分离。
查看答案和解析>>
科目:高中化学 来源:2013届四川省成都市高二5月月考化学试卷(解析版) 题型:填空题
(12分)工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g) CH3OH(g)
ΔH =-a
kJ·mol-1
CH3OH(g)
ΔH =-a
kJ·mol-1

(1)上图是该反应在不同温度下CO的转化率随时间变化的曲线。
① a __0(填“>” “<” “=”)。
② 下列说法正确的是_ _(填序号)。
a.1 mol CO(g) 和2 mol H2(g) 所具有的能量小于1 mol CH3OH(g) 所具有的能量
b.将1 mol CO(g) 和2 mol H2(g) 置于一密闭容器中充分反应后放出a KJ的热量
c.升高温度,平衡向逆反应移动,上述热化学方程式中的a值将减小
d.如将一定量CO(g) 和H2(g) 置于某密闭容器中充分反应后放热a KJ,则此过程中有1 mol CO(g) 被还原
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示:

① 该合成路线对于环境保护的价值在于_ _。
② 15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2
吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
。
(3)甲醇燃料电池的工作原理如下左图所示。该电池工作时,c口通入的物质发生的电极
反应式为:_ _。

(4)以上述电池做电源,用上右图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com