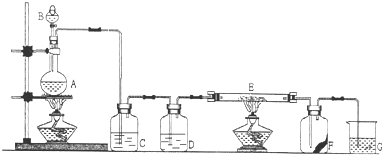
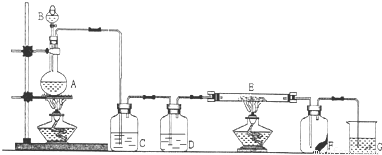
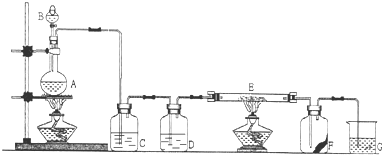
解:(1)由装置图可知B为分液漏斗,故答案为:分液漏斗;
(2)MnO
2与浓盐酸共热制取Cl
2,反应的离子方程式为MnO
2+4H
++2Cl
-
Mn
2++Cl
2↑+2H
2O,故答案为:MnO
2+4H
++2Cl
-
Mn
2++Cl
2↑+2H
2O;
(3)D应为浓硫酸,起到干燥氯气的作用,故答案为:干燥Cl
2;
(4)氯气有强氧化性,能把变价金属氧化成最高价态,所以氯气和铁反应的生成物是氯化铁,反应的化学方程式为2Fe+3Cl
2 
2FeCl
3,
故答案为:2Fe+3Cl
2 
2FeCl
3;
(5)氯气有毒,污染环境,所以不能排空,氯气能和氢氧化钠反应生成氯化钠、次氯酸钠、水,所以可用氢氧化钠吸收多余的氯气,反应的离子方程式为Cl
2+2OH
-=Cl
-+ClO
-+H
2O,
故答案为:Cl
2+2OH
-=Cl
-+ClO
-+H
2O;
(6)F是一张滴有KSCN和FeCl
2混合溶液的滤纸,氯气与氯化亚铁发生氧化还原反应,反应的离子方程式为2Fe
2++Cl
2=2Fe
3++2Cl
-,铁离子与KSCN发生颜色反应,溶液变红,离子方程式为Fe
3++3SCN
-=Fe(SCN)
3,探究滤纸未变红的原因,可取少许褪色后的溶液于试管中,加入KSCN溶液,如果溶液由无色变红色,则甲假设合理;如果不变色,则乙假设合理.
故答案为:2Fe
2++Cl
2=2Fe
3++2Cl
-;Fe
3++3SCN
-=Fe(SCN)
3;取少许褪色后的溶液于试管中,加入KSCN溶液,如果溶液由无色变红色,则甲假设合理;如果不变色,则乙假设合理.
分析:实验室用浓盐酸和二氧化锰在加热条件下制备氯气,反应的离子方程式为MnO
2+4H
++2Cl
-
Mn
2++Cl
2↑+2H
2O,生成氯气具有氧化性,可与铁反应生成氯化铁,与氯化亚铁反应生成氯化铁,氯气和与碱反应生成氯化钠和次氯酸钠,氯气与水反应可生成具有漂白性的次氯酸,但干燥的氯气不具有漂白性,以此解答该题.
点评:本题考查了氯气实验室制取、氯气化学性质、实验设计、实验装置的理解评价、化学方程式的书写等,题目难度中等,是对所学知识的综合运用,注意基础知识的掌握.

 Mn2++Cl 2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl 2↑+2H2O,故答案为:MnO2+4H++2Cl- Mn2++Cl 2↑+2H2O;
Mn2++Cl 2↑+2H2O; 2FeCl3,
2FeCl3, 2FeCl3;
2FeCl3; Mn2++Cl 2↑+2H2O,生成氯气具有氧化性,可与铁反应生成氯化铁,与氯化亚铁反应生成氯化铁,氯气和与碱反应生成氯化钠和次氯酸钠,氯气与水反应可生成具有漂白性的次氯酸,但干燥的氯气不具有漂白性,以此解答该题.
Mn2++Cl 2↑+2H2O,生成氯气具有氧化性,可与铁反应生成氯化铁,与氯化亚铁反应生成氯化铁,氯气和与碱反应生成氯化钠和次氯酸钠,氯气与水反应可生成具有漂白性的次氯酸,但干燥的氯气不具有漂白性,以此解答该题.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案