
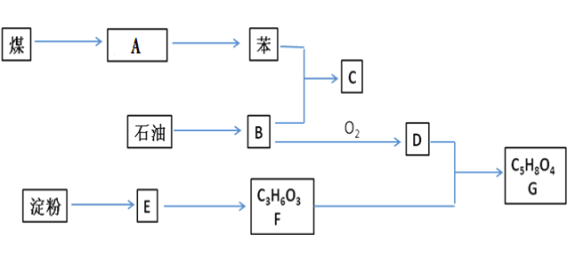
【题目】煤、石油、淀粉都是基础的化工原料,它们之间存在如下关系(部分产物和反应条件未标出)。B为相对分子质量为28的烃;E为淀粉水解的最终产物;F分子中含有一个甲基和一个羧基,lmolF与足量的钠反应能生成标况下22.4LH2;D物质中也含有羧基。
回答下列各题:
(1)若A为煤焦油,则从A中分离出苯的方法是__________,工业上通过石油的________制B物质.
(2)C为乙苯,则苯和B生成C的反应类型是____________, C的结构简式是____________.
(3)写出B制备聚乙烯的反应方程式_____________________________________________.
(4)写出D与F转化为G的反应方程式________________________________________________.
【答案】蒸馏 裂解 加成反应 ![]()
![]()
![]()
【解析】
B是相对分子质量为28的烃,根据商余法,B中碳原子数是28÷14=2,所以B的分子式是C2H4;E为淀粉水解的最终产物,E是葡萄糖;F分子式是C3H6O3,F分子中含有一个甲基和一个羧基,lmolF与足量的钠反应能生成标况下22.4LH2,则F中还有1个羟基,所以F是![]() ;C2H4氧化生成D,D含有羧基,D是CH3COOH;CH3COOH与
;C2H4氧化生成D,D含有羧基,D是CH3COOH;CH3COOH与![]() 发生酯化反应生成G,G是
发生酯化反应生成G,G是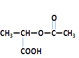 ;
;
(1)若A为煤焦油,煤焦油是多种不同沸点有机物的混合物,则从A中分离出苯的方法是蒸馏;B是乙烯,工业上通过石油的裂解制乙烯。
(2)乙苯的结构简式是![]() ,苯和乙烯生成C的反应类型是加成反应;
,苯和乙烯生成C的反应类型是加成反应;
(3)乙烯发生加聚反应生成聚乙烯,反应方程式是![]() ;
;
(4)CH3COOH与![]() 在浓硫酸作用下发生酯化反应生成
在浓硫酸作用下发生酯化反应生成 ,反应方程式是
,反应方程式是![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其结构如图所示,A、B是多孔性碳制成的两个电极。
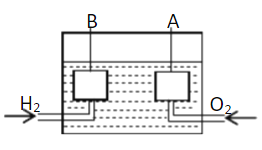
(1)该燃料电池的正极是 (填“A”或“B”),若电解质溶液为KOH溶液,则负极的电极反应式为 ;一段时间后,溶液的pH会 (填“变大”“变小”或“不变”)。
(2)若电解质溶液为硫酸,则正极的反应式为 。
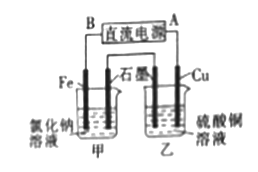
(3)若用该氢氧燃料电池作电源电解氯化钠溶液和硫酸铜溶液,装置如图所示,则铁电极上产生的气体为 (填化学式);一段时间后,铜电极的质量减少6.4g,则甲池中石墨电极上产生气体的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
2mL1mol/LBaCl2溶液 4mL1mol/LNaHCO3溶液 | 2mL1mol/LBaCl2溶液 4mL1mol/LNa2SO3溶液 | 2mL1mol/LBaCl2溶液 4mLH2SO3溶液 |
A.实验①中生成的沉淀是BaCO3
B.实验①中有气体生成
C.实验②沉淀中可能含有BaSO4
D.实验③生成沉淀的离子方程式是:Ba2++H2SO3=BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸与碳酸钙反应生成CO2,运用下图,可测定该反应的速率.请根据要求填空:
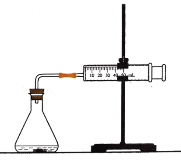
(1)连接好仪器后,需要检查_____________________,再加入药品进行实验.
(2)在锥形瓶中加入5g大理石,加入20mL 1mol·L1盐酸.每隔10s观测玻璃注射器中气体的体积,并以mL·s1为反应速率的单位,计算每10s时间间隔内的反应速率。数据处理的结果见下面的表格:
时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
反应速率/mL·s1 | 0.4 | 1.0 | 1.1 | ? | 0.9 | 0.8 |
表格中的“?”处应填的数据是_________________.
(3)从反应速率随时间变化的数据可知,本实验中反应速率与___________和__________有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全氮类物质具有高密度、超高能量及爆炸产物无污染等优点,被称为没有核污染的“N2爆弹”。中国科学家胡炳成教授团队近日成功合成全氮阴离子N5-,N5-是制备全氮类物质N10(其中含有![]() 和N5-两种离子)的重要中间体。下列说法中不正确的是( )
和N5-两种离子)的重要中间体。下列说法中不正确的是( )
A.全氮类物质属于绿色能源B.每个N5+中含有5个原子核
C.每N5-中含有36个质子D.N10结构中含非极性共价键和离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:6H2(g)+2CO2(g)![]() C2H5OH(g)+3H2O(g)的数据如图所示。
C2H5OH(g)+3H2O(g)的数据如图所示。
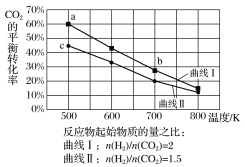
下列说法正确的是( )
A.该反应为吸热反应
B.达平衡时,v正(H2)=v逆(CO2)
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解的知识叙述中,错误的是
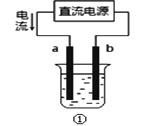
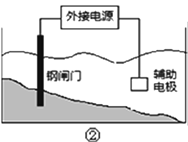
A.用装置①精炼铜,则a极为粗铜,电解质溶液可为CuSO4溶液
B.工业上通过电解氯化钠溶液的方法制备金属钠
C.装置②的钢闸门应与外接电源的负极相连
D.向电子元件上镀上一层银,常需要电子元件做阴极,金属银作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是
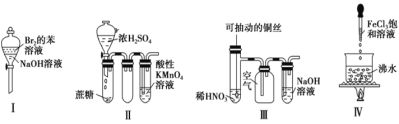
① 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
② 实验Ⅱ:酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
③ 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
④ 实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
A.①②B.③④C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。A为含硫氮正盐其中硫元素化合价为+4,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:

(1)写出下列物质化学式:D:__________;F:__________。
(2)写出下列反应的离子方程式:
①A和酸性KMnO4溶液反应__________;
②D和新制氯水:__________。
(3)通过本题的解答,在检验SO42-时,应使用__________。
A.盐酸酸化的BaCl2溶液 B.硝酸酸化的Ba(NO3)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com