
【题目】下列关于电解的知识叙述中,错误的是
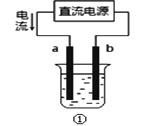
A.用装置①精炼铜,则a极为粗铜,电解质溶液可为CuSO4溶液
B.工业上通过电解氯化钠溶液的方法制备金属钠
C.装置②的钢闸门应与外接电源的负极相连
D.向电子元件上镀上一层银,常需要电子元件做阴极,金属银作阳极
科目:高中化学 来源: 题型:
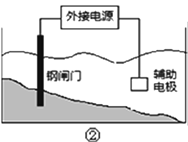
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的排放会带来全球“温室”效应,因此,引起国际关注和研究,渴望21世纪 CO2将作为新碳源被广泛使用。
(1)以 CO2 和 H2 为原料可得到 CH4 燃料。
已知:① CH4 (g) + CO2(g) = 2CO(g) + 2H2(g) △ H1= + 247kJ·mol-1
② CH4 (g) + H2O(g) = CO(g) + 3H2(g) △ H2= + 205kJ·mol-1
写出由 CO2 获得CH4的热化学方程式:_____。
(2)CO2与CH4经催化重整可制得合成气:CH4(g)+CO2(g) = CO(g)+2H2(g) 按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率影响如图所示。此反应优选温度为900℃的原因是______________________。


(3)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
① 催化剂的催化效率与乙酸的生成速率随温度的变化关系如上图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是__________________。
② 为了提高该反应中CH4的转化率,可以采取的措施是________(写出两种) 。
③ 将Cu2Al2O4溶解在稀硝酸中离子方程式是________________________。

(4)O2辅助的Al—CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:_______________________。电池的正极反应式:2CO2+2e= C2O42该过程中,O2起催化作用,催化过程可表示为:i: 6 O2 + 6e = 6 O2 ii: ……写出ii的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、石油、淀粉都是基础的化工原料,它们之间存在如下关系(部分产物和反应条件未标出)。B为相对分子质量为28的烃;E为淀粉水解的最终产物;F分子中含有一个甲基和一个羧基,lmolF与足量的钠反应能生成标况下22.4LH2;D物质中也含有羧基。
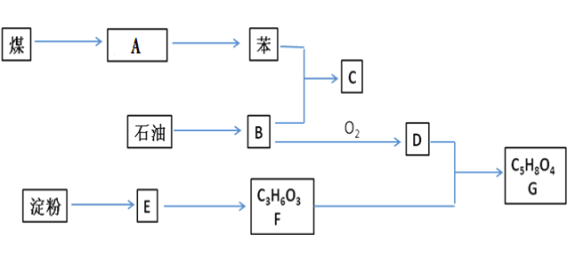
回答下列各题:
(1)若A为煤焦油,则从A中分离出苯的方法是__________,工业上通过石油的________制B物质.
(2)C为乙苯,则苯和B生成C的反应类型是____________, C的结构简式是____________.
(3)写出B制备聚乙烯的反应方程式_____________________________________________.
(4)写出D与F转化为G的反应方程式________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL含有0.1molCl2的氯水中滴加2mol·L1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
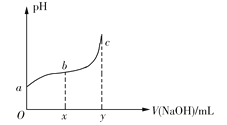
A.若a点pH=4,且c(Cl)=mc(HClO),则HClO的电离平衡常数为![]()
B.若x=100,b点对应溶液中,c(OH)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中,c(OH)c(H+)=2c(Cl)+c(HClO)
D.b→c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 ![]() H+ +HO2-,HO2-
H+ +HO2-,HO2- ![]() H+ +O22-。
H+ +O22-。
编号 | 实验 | 现象 |
Ⅰ | 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出现少量气泡 |
Ⅱ | 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
Ⅲ | 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=__,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:__(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、100kPa时,1L水中可溶解0.09molCl2,实验测得溶于水的Cl2约有三分之一与水反应。下列说法正确的是
A.氯气与水反应的离子反应方程式为:Cl2 + H2O ![]() 2H+ + Cl—+ ClO—
2H+ + Cl—+ ClO—
B.为了增大氯水中HClO的浓度,可以向氯水中加入足量的NaOH固体,使氯气与水反应的平衡向右移动
C.向该条件下的氯水中加入盐酸,氯气与水反应的平衡移动方向与盐酸的浓度有关
D.向氯水中通入HCl气体,氯气与水反应的平衡向左移动,氯水的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
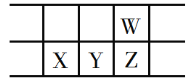
A.原子半径:Y>W
B.Y原子通常得失电子都不容易,但在自然界中,Y元素不存在游离态
C.最低价氢化物的沸点:W<Z
D.X的最高价氧化物的水化物既能与酸反应又能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lg c(Ag+),Ksp(AgCl)=1×10-12。如图是向10 mL AgNO3溶液中逐渐加入0.1 mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论正确的是

A. 原AgNO3溶液的物质的量浓度为也为0.1 mol·L-1
B. 图中x点的坐标为(10,6)
C. 图中x点可认为溶液中Ag+被沉淀完全
D. 把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI,则图像在终点后变为虚线部分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com