
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,反应物总能量<生成物总能量 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 相同条件下,1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的NaOH溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量 |
分析 A.该反应为放热反应,则反应物总能量大于生成物总能量;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成液态水;
C.氢原子形成氢气分子时放出能量,则2E1>E2;
D.浓硫酸溶于水放热,导致放出的热量增大.
解答 解:A.Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,该反应为放热反应,则反应物总能量>生成物总能量,故A错误;
B.氢气燃烧生成液态水时放出的热量才是燃烧热,由热化学方程式可知,氢气的燃烧热<-241.8kJ•mol-1,故B错误;
C.原子形成化学键时放出能量,则2mol氢原子所具有的能量大于1mol氢分子所具有的能量,即2E1>E2,故C正确;
D.浓硫酸溶于水会放出热量,则含1 mol NaOH的NaOH溶液与含0.5 mol H2SO4的浓硫酸混合后放出的热量大于57.3 kJ,故D错误;
故选C.
点评 本题考查较为综合,涉及燃烧热、反应热有关计算、热化学方程式等知识,注意对概念与热化学方程式的理解,题目难度不大.


科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:填空题
煤的直接燃烧会对大气造成严重污染,是雾霾形成的一个重要原因。实现煤的清洁利用迫在眉睫。乙醇、甲醇、尿素等均与煤化工相关。
Ⅰ.(1)将煤转化成水煤气可有效提高能源利用率:
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
(2)一定温度下,在体积可变的容器中投入反应物进行此反应,则下列说法正确的是
A.体系中加入催化剂(其他条件保持不变),平衡不移动但反应的ΔH 将变大
B.若正、逆反应比值恒定,则说明平衡已建立
C.建立平衡后,加压,气体的平均相对分子质量将增大
D.建立平衡后,加压,平衡向逆方向移动,平衡常数减小
Ⅱ.乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
在一定压强下,测得上述反应的实验数据如下表。

根据表中数据分析:
(3)上述反应的a 0(填“>”“<”或“=”)
(4)在温度为T1时,该反应的平衡常数K=1,在2L密闭容器中加入一定量体系各物质,反应的某时刻测得反应体系中各气体均为1mol。
①此时V(CO2)正= V(CO2)逆(填“>”“<”或“=”)
②若反应在恒压绝热容器中进行,达平衡后,CO2的物质的量
A.大于1mol B.等于1mol C.小于1mol D.不确定
Ⅲ.CO2亦是合成尿素的重要原料,以CO2与NH3为原料合成尿素[化学式为[CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) ΔH=+l59.5kJ·mol-1
②NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有杀菌和止痛作用,药皂中也掺入少量的苯酚,所以我们可以用苯酚进行消毒或直接涂抹到皮肤上起消毒作用 | |
| B. | 工业酒精不能加水而当美酒品尝,因其中含有甲醇,它虽然也具有酒香气味,但饮后会造成人的双目失明甚至死亡 | |
| C. | 蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水 | |
| D. | 不粘锅的表面涂有聚四氟乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液中逐滴加少量盐酸:CO32-+H+═HCO3- | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| C. | 向FeBr2溶液中通入过量Cl2的离子方程式:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 过氧化氢能使酸性KMnO4溶液褪色:3H2O2+2MnO4-+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ”或“
”或“ ”表示化学键断裂处,“
”表示化学键断裂处,“ ”表示生成的化学键( )
”表示生成的化学键( )| A. | 乙醇催化氧化: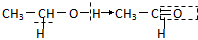 | B. | 乙酸和乙醇的酯化反应: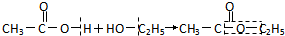 | ||
| C. | 溴乙烷的消去反应: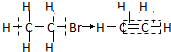 | D. | 乙醛的还原反应: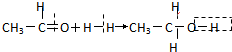 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们互为同分异构体 | B. | 丙酸分子之间存在氢键 | ||
| C. | 它们可用核磁共振氢谱法鉴别 | D. | 它们可用KMnO4(H+)溶液鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com