
| A、HBO2 |
| B、H3BO3 |
| C、H2BO3 |
| D、H4B2O5 |


科目:高中化学 来源: 题型:
 的不饱和度为
的不饱和度为 的系统命名为
的系统命名为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气象环境报告中的“PM2.5”是对一种新分子的描述 |
| B、地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |
| C、“玉兔号”月球车太阳能电池帆板的材料是二氧化硅 |
| D、高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度均为0.1mol?L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4 |
| B、为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C、常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 |
| D、常温下KSP(AgCl)=1.5×10-4,此时将足量氯化银固体分别投入相同体积的①蒸馏水②0.1mol/L盐酸③0.1mol/L氯化镁溶液④0.1mol/L硝酸银溶液中,则溶液中Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol Fe2+与含0.5 mol H2O2溶液反应,转移NA个电子(NA表示阿伏加德罗常数) | ||
B、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
| ||
| C、复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是2 Fe3++3SO42-+3Ba2++6 OH-=3BaSO4↓+2Fe(OH)3↓ | ||
| D、向2mL 0.1mol/L的硝酸银溶液中滴加几滴0.1mol/L氯化钠溶液,产生白色沉淀,再滴加几滴硫化钠溶液,产生黑色沉淀,说明氯化银能转化为更难溶的硫化银 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl-离子中含有的电子数为8nA |
| B、标准状况下,2.24 L H20中含有的分子数为nA |
| C、27g铝与足量的氧气反应,转移的电子数为3nA |
| D、0.2 mo1?L-1 Ca(NO3)2溶液中含有的N03-离子数为0.4nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水溶液Na+ K+ NO3- CH3CHO |
| B、氢氧化钠溶液AlO2- K+ Cl- NO3- |
| C、氢氧化铁胶体H+ K+ S2- Cl- |
| D、高锰酸钾溶液H+ Na+ SO42- CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法正确的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法正确的是( )| A、反应2NO2(g)?N2O4(g)的正反应为吸热反应 |
| B、上述过程中,A烧瓶内正反应速率加快,逆反应速率减慢 |
| C、上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 |
| D、上述过程中,A烧瓶内气体密度减小、B烧瓶内气体密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解质 | 平衡方程式 | 平衡常数K | ||||||
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | ||||||
| H2CO3 | H2CO3?H++HCO
HCO
|
K1=4.31×10-7 K2=5.61×10-11 | ||||||
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | ||||||
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 |
- 3 |
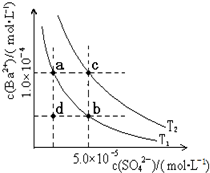
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com