
(14分)工业常利用CO来制氢气。已知在25℃时:
C(s,石墨) + 1/2 O2(g) =" CO(g) " △H1= -111kJ/mol
H2(g) + 1/2 O2(g) = H2O(g) △H2= -242kJ/mol
C(s,石墨) + O2(g) = CO2(g) △H3= -394kJ/mol
(1)在25℃时,CO(g) + H2O(g)  CO2(g) + H2(g) △H=_____________。
CO2(g) + H2(g) △H=_____________。
(2)在2L密闭容器中,将2 mol CO与3 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
(3)将(2)中的平衡后的混合气体通入300mL 6mol/L NaOH溶液中,充分吸收,所得溶液中离子浓度由大到小的顺序为____________________________________ _____________。
_____________。
(4)将(3)中剩余的气体通过足量浓硫酸后,再与足量氧气用电火花引燃后通入足量的过氧化钠中,过氧化钠的质量增重______g。
(5)工业上也可以用CO和H2生产甲醇:CO(g) + 2H2 (g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变,
(g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变, 增大容器的体积,则平衡_________(填字母)
增大容器的体积,则平衡_________(填字母)
| A.不移动 | B.向正反应方向移动 |
| C.向逆反应方向移动 | D.无法判断移动的方向 |
科目:高中化学 来源:2013-2014学年福建省泉州市高三质检理综化学试卷(解析版) 题型:填空题
碳及其化合物应用广泛。
I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图__________。
(2)向1L恒容密闭容器中注人CO和H2o(g),830℃时测得部分数据如下表。则该温度下反应的平衡常
数K=______________。

(3)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2molCO2和2mo1 H2,此时v(正 ) __________v(逆)(填“>”“=”或“<”)
II.已知CO(g)+1/2 O2 (g)=CO2 (g)????????????? △H=一141 kJ·mol-1
2H2(g)+ O2(g)=2H2O(g)??????????????????????? △H=一484 kJ·mol-1
CH3OH(1)+3/2O2 (g)=CO2(g)+2H2O(g)????????? △Hl=一726 kJ·mol-1
(4)利用CO、H2化合制得液态甲醇的热化学方程式为___________。
III.一种新型氢氧燃料电池工作原理如下图所示
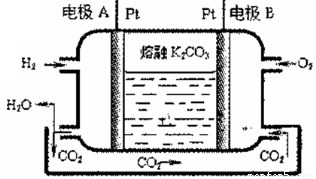
(5)写出电极A的电极反应式_____________。
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通人O2的体积为_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三第三次模拟考试(理综)化学部分 题型:填空题
(14分)工业常利用CO来制氢气。已知在25℃时:
C(s,石墨) + 1/2 O2(g) = CO(g) △H1= -111kJ/mol
H2(g) + 1/2 O2(g) = H2O(g) △H2= -242kJ/mol
C(s,石墨) + O2(g) = CO2(g) △H3= -394kJ/mol
(1)在25℃时,CO(g)
+ H2O(g)  CO2(g) + H2(g) △H=_____________。
CO2(g) + H2(g) △H=_____________。
(2)在2L密闭容器中,将2
mol CO与3 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)  CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
(3)将(2)中的平衡后的混合气体通入300mL 6mol/L NaOH溶液中,充分吸收,所得溶液中离子浓度由大到小的顺序为_________________________________________________。
(4)将(3)中剩余的气体通过足量浓硫酸后,再与足量氧气用电火花引燃后通入足量的过氧化钠中,过氧化钠的质量增重______g。
(5)工业上也可以用CO和H2生产甲醇:CO(g) + 2H2 (g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变,增大容器的体积,则平衡_________(填字母)
A.不移动 B.向正反应方向移动
C.向逆反应方向移动 D.无法判断移动的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是最重要的氮肥,是产量最大的化工产品之一,其合成原理为
N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4KJ/moL。试回答下列问题:
2NH3(g) △H=-92.4KJ/moL。试回答下列问题:
氨的合成是一个可逆反应,为了探索合成氨的最佳条件,人们进行了大量的研究。
(1) 下列有关做法不适宜的是( )
A、常采用循环法,使未转化的氮气和氢气得到充分的利用。
B 、综合考虑各方面的因素,压强控制在20―50MPa之间为宜
C、利用电解水制氢气,作为合成氨的原料,
D、使用铁触媒为催化剂,在5000C时获得最大催化效益。
(2)合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A 、采用较高压强(20―50MPa)
B、采用5000C的高温
C、用铁触媒为催化剂
D、将生产的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(3)在298K时,将10moL N2和30moL H2放入合成塔中,为何放出的热量小于924KJ?
(4)怎样知道在合成氨工业有氨气生成?
如果提高单位时间内氨气的产量,对温度而言,在 (填高温或低温)下有利.
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)工业常利用CO来制氢气。已知在25℃时:
C(s,石墨) + 1/2 O2(g) = CO(g) △H1=-111kJ/mol
H2(g) + 1/2 O2(g)= H2O(g) △H2= -242kJ/mol
C(s,石墨) + O2(g) = CO2(g) △H3=-394kJ/mol
(1)在25℃时,CO(g)+ H2O(g) CO2(g) + H2(g) △H=_____________。
(2)在2L密闭容器中,将2mol CO与3 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
(3)将(2)中的平衡后的混合气体通入300mL 6mol/L NaOH溶液中,充分吸收,所得溶液中离子浓度由大到小的顺序为_________________________________________________。
(4)将(3)中剩余的气体通过足量浓硫酸后,再与足量氧气用电火花引燃后通入足量的过氧化钠中,过氧化钠的质量增重______g。
(5)工业上也可以用CO和H2生产甲醇:CO(g) + 2H2 (g) = CH3OH(g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变,增大容器的体积,则平衡_________(填字母)
A.不移动 B.向正反应方向移动
C.向逆反应方向移动 D.无法判断移动的方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com