
【题目】研究钠及其化合物有重要意义。
(1)实验室配制0.1molL-1的碳酸钠溶液480mL,根据配制溶液的过程,回答问题:
①实验中除需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是_________。
②实验中需用托盘天平(带砝码)称量碳酸钠固体_______________g。
③某同学配制 Na2CO3溶液的过程如图所示。你认为该同学的错误有___________。
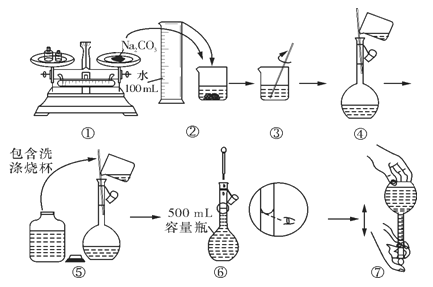
A.①⑥ B.②④⑦ C.①⑤⑥ D.⑤⑥⑦
④下列实验操作会使配得的溶液浓度偏小的是___________。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.容量瓶使用前没有经过干燥,瓶中有少量的水
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
(2)过氧化钠保存不当容易变质生成Na2CO3。某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液和水,证明过氧化钠已经部分变质:_________________(说明操作、现象和结论)。
【答案】 500mL容量瓶、胶头滴管 5.3 A AD 取少量样品于一洁净试管中,加水溶解,向其中加入BaCl2(或CaCl2)溶液,充分振荡,有白色沉淀生成,证明Na2O2已经变质
【解析】(1)①要配制0.1molL-1的碳酸钠溶液480mL,实验室没有480mL的容量瓶,需要选用500mL的容量瓶,配制步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,需要使用的仪器有:托盘天平、玻璃棒、烧杯、药匙、500mL容量瓶、胶头滴管等,还缺少的玻璃仪器为:500mL容量瓶、胶头滴管。
故答案为:500mL容量瓶;胶头滴管;
②依据m=CVM,需要Na2CO3的质量=0.1molL1×0.5L×106g/mol=5.3g;
故答案为:5.3;
③、操作①中称量Na2CO3质量,药品与砝码位置颠倒,正确方法应该为“左物右码”,否则导致称量的碳酸钠质量偏小,故①错误;操作②、③为溶解Na2CO3,使用玻璃棒搅拌,加速溶解过程,操作正确,故②③正确;步骤④为转移冷却后的碳酸钠溶液,需要使用玻璃棒引流,玻璃棒下端放到容量瓶刻度线一下,过程正确,故④正确;步骤⑤为转移洗涤烧杯、和玻璃棒的溶液,该操作正确,故⑤正确;操作⑥为使用胶头滴管定容,定容时眼睛应该与容量瓶刻度线平视,不能仰视刻度线,故⑥错误;操作⑦为摇匀操作,摇匀时应该上下颠倒充分摇匀,故⑦正确;所以以上错误操作有①⑥,故选A。
④A、转移溶液后,未洗涤烧杯和玻璃棒就直接定容,会导致溶质n偏小,溶液浓度偏小,故A正确;B、溶解后立即转移,由于Na2CO3溶于水放热,热胀冷缩,导致溶液V减小,浓度偏大,故B错误;C、进行定容时,俯视刻度线,会导致溶液体积偏小,浓度偏大,故C错误;D、定容且把容量瓶倒置摇匀后,发现液面下降,此时有少量溶液残留在玻璃塞和瓶口之间,浓度不变,属于正常现象,但又补充了水,会导致浓度偏小,故D正确。故答案为:AD。
Na2O2保存不当容易变质,生成Na2CO3,所以检查Na2O2是否变质,只需检验CO32-,选用BaCl2溶液,方法是取少量样品,溶解,加入BaCl2(或CaCl2)溶液,充分振荡,有白色沉淀,证明Na2O2已经变质。
故答案为:取少量样品于一洁净试管中,加水溶解,向其中加入BaCl2(或CaCl2)溶液,充分振荡,有白色沉淀生成,证明Na2O2已经变质。


科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( ) ①FeS2![]() SO2
SO2![]() H2SO4
H2SO4
②SiO2![]() SiCl4
SiCl4![]() Si
Si
③饱和NaCl溶液 ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④Al ![]() NaAlO2
NaAlO2![]() AlCl3(aq)
AlCl3(aq) ![]() AlCl3(s)
AlCl3(s)
⑤CuSO4(aq) ![]() Cu(OH)2
Cu(OH)2![]() Cu2O.
Cu2O.
A.①③⑤
B.②③④
C.②④⑤
D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=﹣4b kJ/mol
B.C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3CH2CH2CH3和CH3CH(CH3)2的关系是 ( )
A. 互为同位素 B. 互为同系物
C. 互为同分异构体 D. 互为同种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热方程式书写正确的是( )
A.2SO2+O2=2SO3△H=﹣196.6 kJ/mol
B.2H2(g)+O2(g)=2H2O(l)△H=﹣517.6 kJ/mol
C.H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJ
O2(g)=H2O(l)△H=﹣285.8 kJ
D.C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国科学家道尔顿曾经说过:“有的人能够远远超越其他人,其主要原因与其说是天才,不如说他有专心致志坚持学习和不达目的决不罢休的顽强精神”,道尔顿为近代化学科学的发展作出的卓越贡献是( )
A. 提出元素的概念
B. 建立燃烧现象的氧化学说
C. 提出原子学说,为近代化学的发展奠定坚实的基础
D. 发现元素周期律,把化学元素及其化合物纳入一个统一的体系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的饱和NaOH溶液中加入少量Na2O2固体,恢复到原温度时,下列说法正确的是
A. 溶液中的Na+增多 B. 溶液的碱性增强
C. 溶质的质量分数不变 D. 溶液的质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证甲烷分子中含有碳、氢两种元素,可将其燃烧产物通过①浓H2SO4;②澄清石灰水;③无水硫酸铜.正确的顺序是( )
A.①②③
B.②③
C.②③①
D.③②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com