
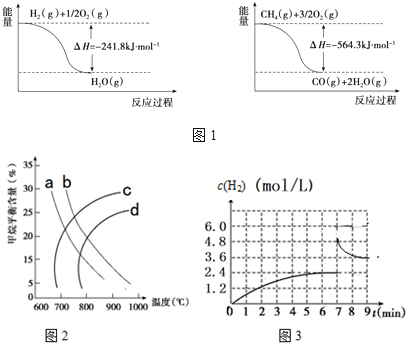
分析 (1)由图1可知:①H2(g)+$\frac{1}{2}$O2(g)→H2O(g)△H=-241.8kJ/mol;
②CH4(g)+$\frac{3}{2}$O2(g)→CO(g)+2H2O(g)△H=-564.3kJ/mol;
由盖斯定律可知,②-3×①得CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H;
(2)①由CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,甲烷的平衡含量会逐渐减小,因此排除曲线c、d,又因增大压强,平衡逆向移动,甲烷的平衡含量增大,故1Mpa是曲线a,2Mpa的是曲线b;
②由CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,平衡常数增大;
③CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)
起始(mol/L):1 1 0 0
变化(mol/L):0.8 0.8 0.8 2.4
平衡(mol/L):0.2 0.2 0.8 2.4
此时CH4的转化率为$\frac{0.8}{1}$×100%=80%;
该温度下反应的平衡常数K=$\frac{0.8mol/L×(2.4mol/L)^{3}}{0.2mol/L×0.2mol/L}$=276.5mol2•L-2;
④由图3可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的$\frac{1}{2}$或增加了等量的氢气,平衡均是逆向移动;
(3)该燃料电池,氢气在负极失去电子生成氢离子,溶液中铵根离子浓度逐渐增大,说明氮气在正极得到电子后与氢离子结合生成NH4+.
解答 解:(1)由图1可知:①H2(g)+$\frac{1}{2}$O2(g)→H2O(g)△H=-241.8kJ/mol;
②CH4(g)+$\frac{3}{2}$O2(g)→CO(g)+2H2O(g)△H=-564.3kJ/mol;
由盖斯定律可知,②-3×①得CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=-564.3kJ/mol-3×(-241.8kJ/mol)=+161.1kJ/mol,
故答案为:CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol;
(2)①由CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,甲烷的平衡含量会逐渐减小,因此排除曲线c、d,又因增大压强,平衡逆向移动,甲烷的平衡含量增大,故1Mpa是曲线a,2Mpa的是曲线b,
故答案为:a;
②由CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,平衡常数增大,因此该反应的平衡常数:600℃时小于700℃,
故答案为:<;
③CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)
起始(mol/L):1 1 0 0
变化(mol/L):0.8 0.8 0.8 2.4
平衡(mol/L):0.2 0.2 0.8 2.4
此时CH4的转化率为$\frac{0.8}{1}$×100%=80%;
该温度下反应的平衡常数K=$\frac{0.8mol/L×(2.4mol/L)^{3}}{0.2mol/L×0.2mol/L}$=276.5mol2•L-2;
故答案为:80%;276.5mol2•L-2;
④由图3可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的$\frac{1}{2}$或增加了等量的氢气,无论是增大压强,还是增大氢气的浓度,平衡均是逆向移动,
故答案为:向逆反应方向;将容器体积缩小为原来的$\frac{1}{2}$或加入等量的氢气;
(3)该燃料电池,氢气在负极失去电子生成氢离子,溶液中铵根离子浓度逐渐增大,说明氮气在正极得到电子后与氢离子结合生成NH4+,则正极反应式为:N2+6e-+8H+=2NH4+,
故答案为:N2+6e-+8H+=2NH4+.
点评 本题考查了盖斯定律的应用、化学平衡影响因素和化学平衡常数以及转化率的计算、燃料电池的电极反应式的书写,综合性较强,为历年高考高频考点,侧重于化学反应原理和图象分析能力的培养,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | CH3COONa溶液与HCl溶液混合所得的中性溶液中:c(Na+)>c(Cl-) | |
| C. | Na2S和NaHS的混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| D. | pH=8的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
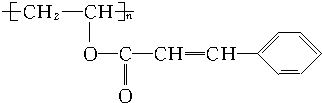
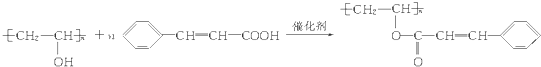 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1:V2的值 | B. | V1和V2的值 | ||
| C. | X和Y的物质的量 | D. | 盐酸和稀硫酸的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2发生氧化反应 | |
| B. | NH4Cl 中的氮元素被还原 | |
| C. | N2既是氧化产物,又是还原产物 | |
| D. | 每生成1mol N2转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BOH的电离方程式是BOH═B++OH- | |
| B. | 将一定体积的上述两种溶液混合后得到中性溶液,则V(HA)<V(BOH) | |
| C. | 在0.1 mol•L-1BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+) | |
| D. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1,则溶液的pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
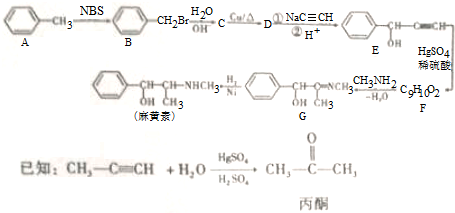

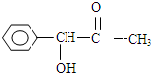 ,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种)
,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种)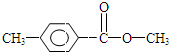 或
或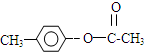 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com