
| A、只有n (K+)相同 |
| B、只有n (Cl-)相同 |
| C、各离子的物质的量完全相同 |
| D、各离子的物质的量完全不同 |


科目:高中化学 来源: 题型:
| 催化剂 |
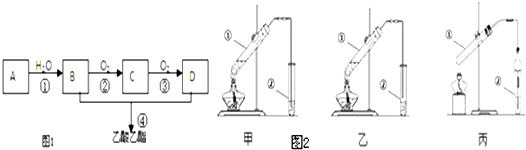
查看答案和解析>>
科目:高中化学 来源: 题型:
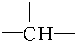 和1个-OH.则B可能结构有4种,已知其中2种结构简式为
和1个-OH.则B可能结构有4种,已知其中2种结构简式为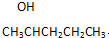 、
、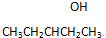 ,请写出另外两种
,请写出另外两种查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
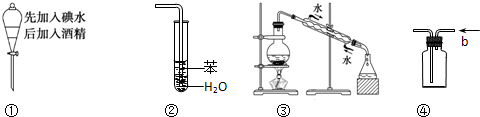
| A、溶液上层无色,下层紫红色 |
| B、装置②可用于吸收HCl气体,并防止倒吸 |
| C、装置③可用于制取蒸馏水 |
| D、装置④b口进气可收集H2、CO2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| PH | 6.5-8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol?L-1 |
| 细菌总数 | <100个?mL-1 |
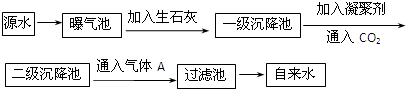
查看答案和解析>>
科目:高中化学 来源: 题型:
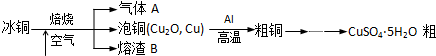
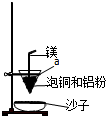
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
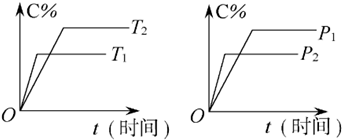
| A、达到平衡后,使用催化剂,C%将增大 |
| B、达到平衡后,若升高温度,化学平衡向逆反应方向移动 |
| C、方程式中n>p+q |
| D、达到平衡后,增加A的量有利于化学平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com