
| 催化剂 |
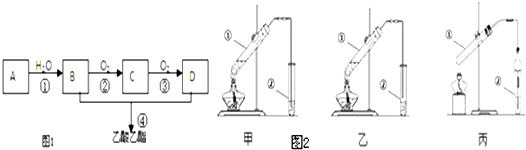
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
| A、用盐酸清除水垢CaCO3+2H+=Ca2++CO2↑+H2O |
| B、Fe跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
| C、澄清石灰水跟稀盐酸:H++OH-=H2O |
| D、碳酸氢钠溶液跟氢氧化钠溶液反应 HCO3-+OH-=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
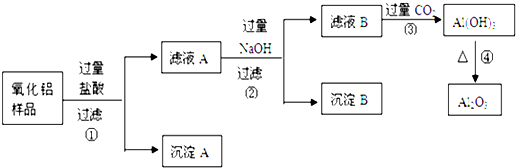
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
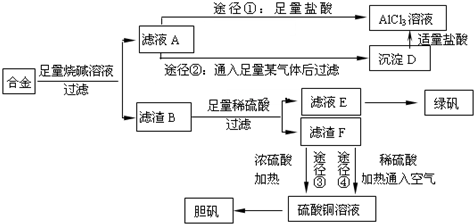
查看答案和解析>>
科目:高中化学 来源: 题型:
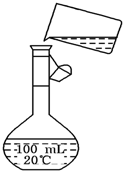 电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO
电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
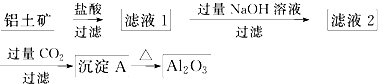
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检测时NaAuCl4发生氧化反应 |
| B、葡萄糖的结构简式为CH2OH(CHOH)4CHO |
| C、葡萄糖具有还原性 |
| D、纳米金颗粒分散在水中所得的分散系能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有n (K+)相同 |
| B、只有n (Cl-)相同 |
| C、各离子的物质的量完全相同 |
| D、各离子的物质的量完全不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com