
【题目】某有机物甲经氧化后得到乙(分子式为C2H3O2Cl);而甲经水解可得到丙,1mol丙和2mol乙反应得到一种含氯的酯(C6H8O4Cl2)由此推断甲的结构简式为
A. Cl-CH2-CH2-OH B. HCOOCH2Cl
C. Cl-CH2-CHO D. HO-CH2-CH2OH
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
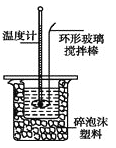
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____________。大烧杯如不盖硬纸板,求得的中和热数值将 (填“偏大”、“偏小”或“无影响”)。结合日常生活实际该实验在 中(家用产品)效果更好。
(3)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(4)取50 mLNaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①表中的温度差平均值为 ℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55 mol·L-1氢氧化钠进行反应,与上述实验相比,所放出的热量 (填相等或不相等,下同),所求的中和热无偏差时 简述理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物一氯代物的数目排列顺序正确的是
①CH3(CH2)4CH3 ②(CH3)2CHCH(CH3)2 ③(CH3)3CCH2CH3 ④(CH3)3CC(CH3)3
A. ①=③>②>④ B. ②>③=①>④ C. ③>②>④>① D. ①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来会宁县区的空气污染指数居高不下,雾霾天气严重,据分析霾中含有硫和氮的氧化物,如SO2、NOx等。
(1)NOx是汽车尾气中的主要污染物之一。
①NOx形成的酸雨被称为硝酸型酸雨,硝酸型酸雨中含有的主要离子有 ;浓硝酸发黄的原因(用化学方程式解释) 。
②汽车发动机工作时高温电火花会引发N2和O2反应,反应的化学方程式是 。
(2)因SO2的大量排放形成的酸雨被称为硫酸型酸雨,我国的酸雨主要是硫酸型酸雨。取硫酸型酸雨样品置于空气中,一段时间后发现该酸雨的酸性增强了,你认为原因是: (用化学方程式表示) 。
(3)为减少SO2的排放,常采取一些有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是 。
②下列物质中,可用于吸收烟气中的SO2的最佳溶液是 (填序号)。
a.Na2CO3 b.H2SO4 c.NaHSO3 d.NH3·H2O
(4)取某空气样本用蒸馏水处理制成待测液,其中所含的离子及其浓度如下:
离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算: a= mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活质量的日益提高,废旧电池已成为一个亟待解决的问题,对废旧电池的处理 体现了对资源和环境的可持续发展.人们对废旧电池的处理的主要目的是( )
A.回收电池外壳的金属材料
B.回收电池中的二氧化锰
C.回收电池中的石墨电极
D.防止电池中的重金属汞、镉、铅对土壤、水源的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2===4CuSO4+2H2O,该反应的还原剂是________________。当1 mol O2发生反应时,还原剂所失电子的物质的量为_________mol。
(2)焙烧明矾的化学方程式为4KAl(SO4)2·12H2O+3S===2K2SO4+2Al2O3+9SO2+48H2O,在该反应中,还原剂是_____________。
(3)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________。
(4)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
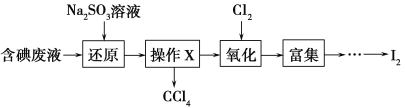
向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_________________;该操作将I2还原为I-的目的是________________________。
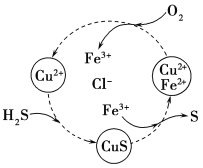
(5)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是________________。
(6)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为________________,反应消耗1 mol NaBH4时转移的电子数目为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com