
| 1g |
| 58g/mol |
| 1 |
| 58 |
| 13 |
| 2 |
| 13 |
| 2 |
| c4(H2O) |
| C4(H2) |
| c4(H2O) |
| C4(H2) |
| ||


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
| A、二氧化硅是酸性氧化物,可以与氢氧化钠等强碱溶液反应 |
| B、因为碘易溶于酒精,所以常用酒精萃取碘水中的碘 |
| C、王水、盐酸、水玻璃均为混合物 |
| D、二氧化硅晶体中,1个硅原子与4个氧原子相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③⑥ | C、②④ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
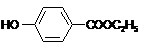 ,生产过程如下图:
,生产过程如下图: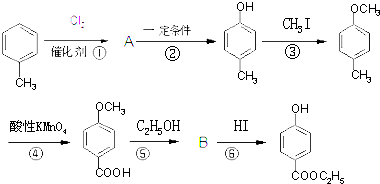
 的分子式为
的分子式为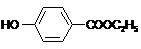 中的含氧官能团名称是
中的含氧官能团名称是 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
| B、浓度均为0.2 mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| C、c(Mg2+)为0.11 mol?L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| R | T | |
| X | Y | Z |
| A、R的其中一种单质可用做电极材料 |
| B、五种元素中原子半径最大的是X |
| C、气态氢化物稳定性:Y>T |
| D、Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶 液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) |
| B、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=KW1X10-9mol?L-1 |
| C、实验②反应后的溶液中:c(A-)+c(HA)>0.1mol?L-1 |
| D、实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:3 |
| C、2:1 | D、1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com