
| A、在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
| B、浓度均为0.2 mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| C、c(Mg2+)为0.11 mol?L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
|


科目:高中化学 来源: 题型:
| A、Cl2通入NaOH溶液:Cl2+OH-→Cl-+ClO-+H2O |
| B、用CH3COOH溶解CaCO3:CaCO3+2H+→Ca2++H2O+CO2↑ |
| C、Cu溶于稀HNO3:3Cu+8H++2NO3-→3Cu2++2NO↑+4H2O |
| D、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O→AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
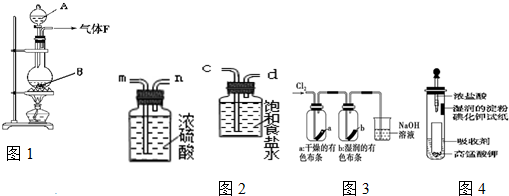
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
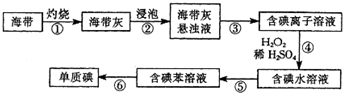
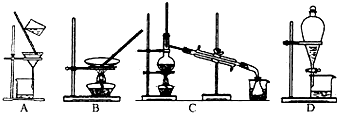
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | Z | R |
| W |
| A、五种元素的原子最外层电子数一定都大于2 |
| B、X、Z原子序数可能相差18 |
| C、Z可能是氯元素 |
| D、Z的氧化物与X单质不可能发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盛有被KCl饱和溶液浸泡过的琼脂的U型管,可用作原电池的盐桥 |
| B、Al3+能水解为Al(OH)3胶体,明矾可用作净水剂 |
| C、碳酸钠溶液显碱性,常用来制胃酸 |
| D、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.4g | B、3.6g |
| C、2.7g | D、1.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com