
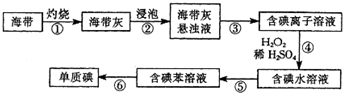


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
| A、HCO3-+CO32-+3H+→2H2O+2CO2↑ |
| B、2HCO3-+CO32-+4H+→3H2O+3CO2↑ |
| C、CO32-+H+→HCO3- |
| D、HCO3-+3CO32-+7H+→4H2O+4CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的溶液 |
| B、pH=2的CH3COOH和pH=12的NaOH溶液等体积混合 |
| C、CH3COONa溶液 |
| D、c(NH+4)=c(Cl-)的NH4Cl和氨水的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
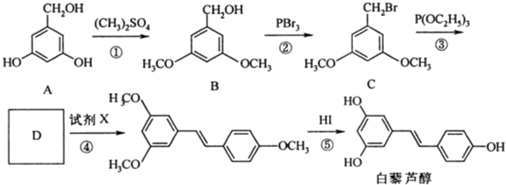
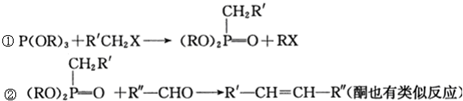
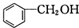 和P(OC2H5)3为原料,选择适当的无机试剂和催化剂,通过合理的途径合成
和P(OC2H5)3为原料,选择适当的无机试剂和催化剂,通过合理的途径合成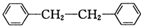 .请补全下列合成路线(含条件、试剂和主要产物的结构简式).
.请补全下列合成路线(含条件、试剂和主要产物的结构简式).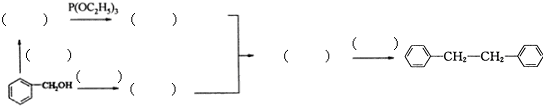
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
| B、浓度均为0.2 mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| C、c(Mg2+)为0.11 mol?L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体和非晶体的区别,就是晶体有自范性,而非晶体没有 |
| B、常温下为气体或者液体的物质,固体时都是分子晶体 |
| C、原子晶体一定是单质元素的原子组成的 |
| D、金属晶体的熔沸点总比分子晶体的熔沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com