
| 0.04mol-0.02mol |
| 0.2L |
| 10-12 |
| 0.1 |


科目:高中化学 来源: 题型:
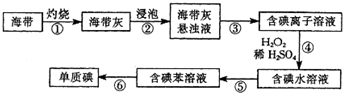
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | Z | R |
| W |
| A、五种元素的原子最外层电子数一定都大于2 |
| B、X、Z原子序数可能相差18 |
| C、Z可能是氯元素 |
| D、Z的氧化物与X单质不可能发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盛有被KCl饱和溶液浸泡过的琼脂的U型管,可用作原电池的盐桥 |
| B、Al3+能水解为Al(OH)3胶体,明矾可用作净水剂 |
| C、碳酸钠溶液显碱性,常用来制胃酸 |
| D、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
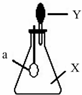 如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体 Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体 Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )| A、X是NH3,Y是水 |
| B、X是CO2,Y是稀硫酸 |
| C、X是SO2,Y是NaOH浓溶液 |
| D、X是 HCl,Y是NaNO3 稀溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、做喷泉实验来验证氨气极易溶解于水的性质 |
| B、金属钠着火时不可以用泡沫灭火器,可用干燥的沙土灭火 |
| C、用NaOH溶液除去混在CO2气体中的HCl |
| D、实验室中保存FeSO4溶液,应向其中加入铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中加入稀盐酸产生无色气体,将产生的气体通入澄清石灰水,石灰水变浑浊,则该溶液中一定含有CO32一 |
| B、某溶液中加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则该溶液中一定含有NH4+ |
| C、某溶液中滴入BaCl2溶液,再滴加稀盐酸,产生白色沉淀,则一定含有SO42一 |
| D、某溶液加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定含有Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com