

 (1)N≡N;
(1)N≡N;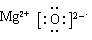 ;第三周期ⅥA族。(2) ①③
;第三周期ⅥA族。(2) ①③ 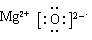 。S元素的原子序数是16,位于第三周期ⅥA族。由于氨水是弱碱,所以氨气极易结合氢离子生成NH4+。
。S元素的原子序数是16,位于第三周期ⅥA族。由于氨水是弱碱,所以氨气极易结合氢离子生成NH4+。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源:不详 题型:推断题
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 NF3+3NH4F
NF3+3NH4F
 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.M<N<Y<X<Z | B.N<M<X<Y<Z |
| C.N<M<Y<X<Z | D.X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |

 ,沸点
,沸点 ,在
,在 以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| H | | | | | | | He |
| 1.3120 | | | | | | | 0.3723 |
| Li | Be | B | C | N | O | F | Ne |
| 0.5203 | 0.8995 | 0.8001 | 1.0864 | 1.4023 | 1.3140 | 1.6810 | 2.0807 |
| Na | Mg | Al | Si | P | S | Cl | Ar |
| 0.4958 | 0.7377 | 0.5776 | 0.7865 | 1.0118 | 0.9996 | 1.2511 | 1.5205 |
| K | Ca | Ga | Ge | As | Se | Br | Kr |
| 0.4189 | 0.5898 | 0.5788 | | 0.9440 | 0.9409 | 1.1399 | 1.3507 |
| Rb | Sr | In | Sn | Sb | Te | I | Xe |
| 0.4030 | 0.5495 | 0.5583 | 0.7086 | 0.8316 | 0.8693 | 1.0084 | 1.1704 |
| Cs | Ba | Tl | Pb | Bi | Po | At | |
 表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用
表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用 表示)的位置。
表示)的位置。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所有的原子核内质子数都比中子数多 |
| B.氢离子(H+)实质上是一个裸露的质子 |
| C.核外电子排布相同的微粒,其化学性质也相同 |
| D.非金属元素原子最外层电子数都大于4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.(水晶)SiO2 | B.冰醋酸 | C.氧化镁 | D.白磷 E.固体氩 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com