
| A. | 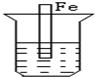 | B. |  | C. | 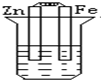 | D. | 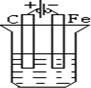 |
分析 先判断装置是原电池还是电解池,再根据原电池正负极腐蚀的快慢和电解池的阴阳极腐蚀快慢来比较,从而确定腐蚀快慢顺序,电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答 解:根据图知,B、C装置是原电池,在B中,金属铁做负极,C中金属铁作正极,被保护而不被腐蚀,而A发生化学腐蚀,速率较慢,原电池中做负极的腐蚀速率快,所以腐蚀速率为B>A>C,D装置是电解池,其中金属铁为阴极,腐蚀速率最慢,所以腐蚀速率是B>A>C>D,
故选D.
点评 本题考查了金属腐蚀快慢判断,为高频考点,明确铁发生的腐蚀类型及作何种电极即可解答,注意外加电源的阴极保护法中金属腐蚀最慢,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 某化合物在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和HCl两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应中转移的电子为n mol,则n一定大于0.15 mol | |
| B. | n(NaCl):n(NaClO):n(NaClO3)可能为7:2:1 | |
| C. | 与NaOH反应的氯气一定为0.15 mol | |
| D. | n(Na+):n(Cl-) 可能为7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
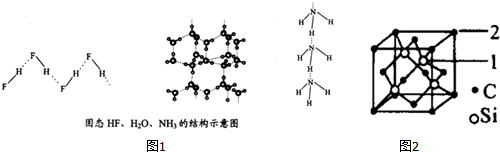
| 物质 | 氢键X-H…Y | 键能KJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径和离子半径均减小 | |
| B. | 金属性减弱,非金属性增强 | |
| C. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| D. | 单质的熔点降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com