
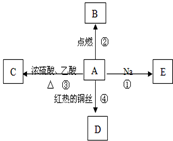
 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.B物质中含有碳元素.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.B物质中含有碳元素.| Cu |
| △ |
| Cu |
| △ |
| △ |
| △ |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
| A、10倍 | ||
| B、20倍 | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3的分解率为20% |
| B、10min内用O2表示的该反应的反应速率为0.005mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、达到平衡时分解的Ag2SO4固体为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
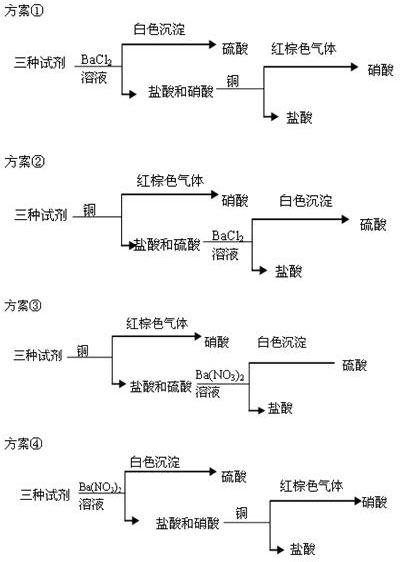
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A是石油裂解气的主要成分,A的产量通常衡量一个国家的石油化工水平;现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知A是石油裂解气的主要成分,A的产量通常衡量一个国家的石油化工水平;现以A为主要原料合成乙酸乙酯,其合成路线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2- | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
| 平行测定数据 | 平均值 | ||||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com