
| A、16g |
| B、32g |
| C、64g/mol |
| D、32g/mol |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
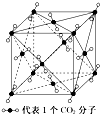 干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立 方体,且在6个面的中心又各有1个CO2分子,在每个CO2周围距离为
干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立 方体,且在6个面的中心又各有1个CO2分子,在每个CO2周围距离为
| ||
| 2 |
| A、4个 | B、8个 | C、12个 | D、6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12g碳所含的碳原子数就是阿伏加德罗常数 |
| B、氦气的摩尔质量是8g |
| C、阿伏加德罗常数通常用NA表示,6.02×1023 mol-1称为阿伏加德罗常数 |
| D、4.4g二氧化碳气体中所含的原子个数与4.2g氮气中所含的原子个数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )| A、反应物的熔沸点 |
| B、反应的完成程度 |
| C、生产能耗 |
| D、反应热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S在O2中燃烧可生成SO3 |
| B、用澄清石灰水可鉴别CO2和SO2 |
| C、SO2能使酸性KMnO4溶液褪色 |
| D、SO2通人BaCl2溶液中能产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示,测得此温度下0~10min内共放出热量为a kJ.
500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示,测得此温度下0~10min内共放出热量为a kJ.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com