
题目
 |
下列物质之间的相互转化不符合 (“→”表示一步反应的是)
| 甲 | 乙 | 丙 | |
| A | Si | SiO2 | H2SiO3 |
| B | CH3CH2OH | CH3CH2Br | CH2==CH2 |
| C | AlCl3 | NaAlO2 | Al(OH)3 |
| D | HClO | Cl2 | HCl |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
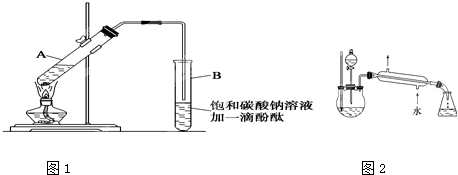
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 时间/S | c(CO2)mol/L | c(H2)mol/L |
| 0 | 1.00×10-1 | 3.00×10-1 |
| 1 | 8.50×10-2 | 2.55×10-1 |
| 2 | 6.50×10-2 | 1.95×10-1 |
| 3 | 5.50×10-2 | 1.65×10-1 |
| 4 | 5.00×10-2 | 1.50×10-1 |
| 5 | 5.00×10-2 | 1.50×10-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 取m1g某常见粉末(由M、Z两种元素组成)进行如下实验.将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水.按图连接仪器并检查好气密性.
取m1g某常见粉末(由M、Z两种元素组成)进行如下实验.将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水.按图连接仪器并检查好气密性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com