
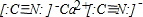 ,
,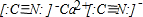 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
| 1 |
| 202 |
| 3 |
| 202 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
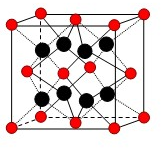 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com