
 .
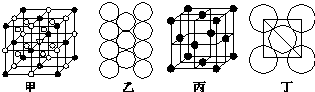
.
分析 (1)冰晶石(Na3AlF6)晶体不导电,但熔融时能导电,说明属于离子化合物,由Na+、[AlF6]3-构成,[AlF6]3-中含有配位键;
(2)CO2分子为直线形结构,可知碳原子采取sp杂化方式,原子数目相等、价电子总数也相等的微粒互为等电子体;
(3)元素的非金属性越强,其电负性越强,F元素电负性最大,F原子核外最外层电子排布式为2s22p5;
(4)利用均摊法计算晶胞中白色球、黑色球数目,再根据化学式判断;
(5)利用均摊法计算Al原子个数,表示出晶胞质量,面对角线上3个Al原子相邻,晶胞棱长为4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)冰晶石(Na3AlF6)晶体不导电,但熔融时能导电,说明属于离子化合物,由Na+、[AlF6]3-构成,[AlF6]3-中含有配位键,也属于极性键,
故选:abc;
(2)CO2分子为直线形结构,可知碳原子采取sp杂化方式,原子数目相等、价电子总数也相等的微粒互为等电子体,和CO2 互为等电子体的氧化物是N2O,
故答案为:直线形;sp;N2O;
(3)元素的非金属性越强,其电负性越强,所以电负性最强的是F元素;F原子核外最外层上s、p能级,s、p能级上电子分别是2、5,其最外层轨道表示式为 ,
,
故答案为:F; ;
;
(4)●的个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,○个数=12×$\frac{1}{4}$+8=11,要使两种离子的个数之比为1:3,则大立方体的体心处所代表的微粒是Na+,
故答案为:Na+;
(5)晶胞中Al原子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量4×$\frac{M}{{N}_{A}}$g,面对角线上3个Al原子相邻,晶胞棱长为4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,则晶胞密度=4×$\frac{M}{{N}_{A}}$g÷(2$\sqrt{2}$d cm)3=$\frac{M}{4\sqrt{2}{a}^{3}{N}_{A}}$g.cm-3,
故答案为:4;$\frac{M}{4\sqrt{2}{a}^{3}{N}_{A}}$g.cm-3.
点评 本题是对物质结构与性质的考查,涉及化学键、空间构型与杂化方式、等电子体、核外电子排布、晶胞计算等,(5)中关键是明确原子半径与晶胞棱长关系掌握均摊法进行晶胞有关计算.


科目:高中化学 来源: 题型:解答题
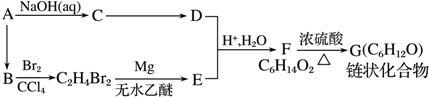
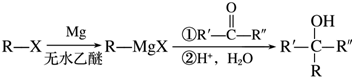 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的酸性溶液:MnO4-、K+、Cl-、SO42- | |
| B. | 0.1 mol/LNaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| D. | 滴加KSCN显红色的溶液:NH4+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
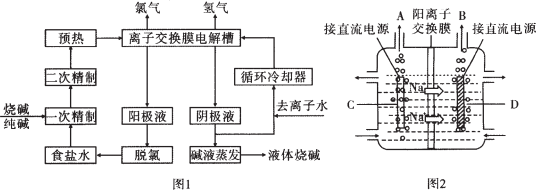
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用碳捕集和储存技术,逐步实现二氧化碳的零排放 | |
| B. | 扩大铅蓄电池、汞锌锰等含重金属元素的干电池的生产,满足消费需求 | |
| C. | 对工业废水、生活污水净化处理,减少污染物的排放 | |
| D. | 催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④ | C. | ③④⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com