
【题目】高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解。
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2![]() MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
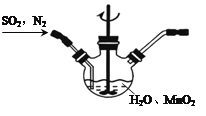
A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)![]() 2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。
2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
③若用空气代替N2进行实验,缺点是________。(酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;② ……;③在70-80℃下烘干得到纯净干燥的MnCO3固体。
步骤②需要用到的试剂有________。
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明KSP(MnCO3) < KSP(NiCO3):________。
(已知NiCO3为难溶于水的浅绿色固体)
(4)证明H2SO4的第二步电离不完全:________。[查阅资料表明K2(H2SO4)=1.1×10-2]
【答案】AB abef 空气中的O2能氧化H2SO3,使SO2利用率下降 乙醇 向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色。(其他合理答案也给分) 用pH计测量Na2SO4溶液的pH大于7(其他合理答案也给分)
【解析】
(1)①增大接触面积,反应速率加快,提高混合其中N2比例,二氧化硫的浓度减小;
②b装置制备二氧化硫,氮气与二氧化硫通过e装置混合,在图1装置中反应生成MnSO4,利用f进行尾气处理,防止污染空气;
③氧气能与亚硫酸反应生成硫酸;
(2)步骤②为洗涤杂质,防止氧化与溶解损失;
(3)利用MnCO3转化为NiCO3浅绿色固体设计;
(4)测定0.1mol/L的硫酸氢钠溶液的pH或Na2SO4溶液pH。
(1)①MnO2研磨、反应时搅拌均可以增大接触面积,加快反应速率,提高混合其中N2比例,二氧化硫的浓度减小,反应速率减小;
故选:AB;
②反应不需要加热制备二氧化硫,b装置制备二氧化硫,氮气与二氧化硫通过e装置混合,在图1装置中反应生成MnSO4,利用f进行尾气处理,防止尾气中二氧化硫污染空气;故选:abef;
③制备原理为:H2SO3+MnO2═MnSO4+H2O,若用空气代替N2进行实验,氧气能与亚硫酸反应生成硫酸,二氧化硫利用率降低;
故答案为:空气中的O2能氧化H2SO3,使SO2利用率下降;
(2)步骤②为洗涤杂质,MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,应用乙醇洗涤,可以防止被氧化,因溶解导致的损失;
故答案为:乙醇;
(3)先向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色,可证明KSP(MnCO3)<KSP(NiCO3);
故答案为:向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色;
(4)配制0.1mol/L NaHSO4溶液,测定溶液pH>1,则说明H2SO4的第二步电离不完全,或用pH计测量Na2SO4溶液的pH大于7,也可证明H2SO4的第二步电离不完全;
故答案为:配制0.1mol/L NaHSO4溶液,测定溶液pH>1,说明H2SO4的第二步电离不完全(或用pH计测量Na2SO4溶液的pH大于7)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯原子对O3分解有催化作用:
O3+Cl===ClO+O2 ΔH1
ClO+O===Cl+O2 ΔH2
大气臭氧层的分解反应是:O3+O===2O2 ΔH,该反应的能量变化如图:
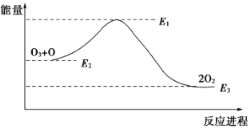
下列叙述中,正确的是
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. ΔH=E3-E2>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用碱式滴定管量取0.1 mol/L的NaOH溶液,开始时仰视液面读数为1.00 mL,取出部分溶液后,俯视液面,读数为11.00 mL,该同学在操作中实际取出的液体体积为( )
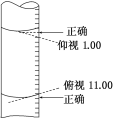
A.大于10.00 mLB.小于10.00 mL
C.等于10.00 mLD.等于11.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用。
![]() 已知
已知![]() 与水反应生成乙炔。请回答下列问题:
与水反应生成乙炔。请回答下列问题:
![]() 将乙炔通入
将乙炔通入![]() 溶液中生成
溶液中生成![]() 红棕色沉淀,
红棕色沉淀,![]() 基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成
基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成![]() 和Cu,但CuO在高温下会分解成
和Cu,但CuO在高温下会分解成![]() ,试从结构角度解释高温下CuO何会生成
,试从结构角度解释高温下CuO何会生成![]() :______。
:______。
![]() 中
中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 中含有的
中含有的![]() 键数目为 ______ 。
键数目为 ______ 。
![]() 乙炔与氢氰酸反应可得丙烯腈
乙炔与氢氰酸反应可得丙烯腈![]() 丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
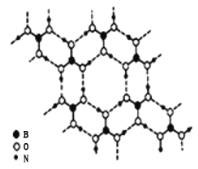
![]() 硼酸
硼酸![]() 是一种片层状结构的白色晶体,层内的
是一种片层状结构的白色晶体,层内的![]() 分子间通过氢键相连
分子间通过氢键相连![]() 如图
如图![]() 则
则![]() 的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸
的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸![]() ,它电离生成少量
,它电离生成少量![]() 和
和![]() ,则
,则![]() 含有的化学键类型为 ______ 。
含有的化学键类型为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,合成氨反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
A. 一定小于92.0 kJ B. 一定大于92.0 kJ
C. 一定等于92.0 kJ D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识.下图是某化学兴趣小组设计的乙醇催化氧化的实验装置。(提示:通常用新制的Cu(OH)2悬浊液产生砖红色沉淀来检验物质中含有醛基)。
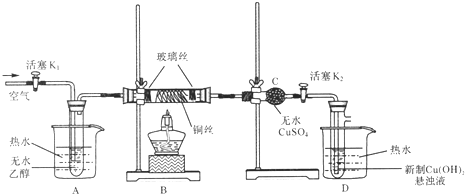
请据图回答以下问题:
(1)仪器连接安装完毕,进行实验前如何检验装置的气密性?答:_____________;
(2)对A中的乙醇采用水浴加热的目的是____________;
(3)实验时,点燃B处的酒精灯后,先____________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是____________,发生的主要反应的化学方程式为____________,当反应进行一段时间后,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个____________反应(填“吸热”或“放热”).
(4)装置C的作用是____________,能在此处观察到的现象是____________;
(5)装置D中的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分反应的产物已略去)。A只含两种元素,摩尔质量为72g·mol1。B是无色气体,其水溶液是常见的酸,C是常见金属,E的组成元素与水相同,其水溶液常用于实验室制氧气,H的俗名是熟石灰,J为红褐色固体。

(1)A的化学式为___。
(2)D的电子式为___。
(3)写出反应③的离子方程式:___。
(4)写出反应④的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示装置的判断,叙述正确的是( )

A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中的电子流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com