
| A. | H2S?2H++S2- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaCl═Na++Cl- | D. | CH3COOH═CH3COO-+H+ |
分析 强电解质完全电离,用等号;弱电解质部分电离,用可逆号;
多元弱酸分步电离,以第一步为主,多元弱酸的酸式根离子不能拆,据此解答.
解答 解:A.硫化氢为弱电解质,电离方程式:H2S?H++HS-,故A错误;
B.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故B错误;
C.氯化钠为强电解质,完全电离,电离方程式:NaCl═Na++Cl-,故C正确;
D.醋酸为弱电解质,部分电离,电离方程式:CH3COOH?CH3COO-+H+,故D错误;
故选:C.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意多元弱酸分步电离,以第一步为主,多元弱酸的酸式根离子不能拆,题目难度不大.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度和减小压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
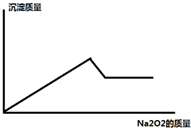 某溶液中,可能含有Al3+、Fe3+、K+、Mg2+、Fe2+、Cu2+中的一种或几种,现加入过氧化钠只产生无色无味的气体 并同时析出白色沉淀,加入过氧化钠的量与产生沉淀的量之间的关系如图
某溶液中,可能含有Al3+、Fe3+、K+、Mg2+、Fe2+、Cu2+中的一种或几种,现加入过氧化钠只产生无色无味的气体 并同时析出白色沉淀,加入过氧化钠的量与产生沉淀的量之间的关系如图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25ml的碱式滴定管量取14.80mlNaOH溶液 | |
| B. | 用100ml量筒量取5.2ml的盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用100ml容量瓶配制50ml1.0mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
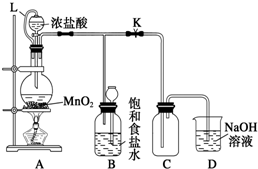
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过品红溶液 | |
| B. | 先通过氢氧化钠溶液,再通过澄清石灰水 | |
| C. | 先通过饱和碳酸氢钠溶液,再通过澄清石灰水 | |
| D. | 先通过酸性高锰酸钾溶液,再通过澄清石灰水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com