
下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有c(Ba2+)= c(SO42-)=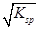
③将0.1mol·L-1的NaHS和0.1mol·L-1 Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1 mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
| A.①④ | B.②③ | C.③④ | D.①② |
C
解析试题分析:①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n在pH<=7的条件下成立,错误;②在硫酸钡的单一饱和溶液中式子成立,若向溶液中加入可溶性硫酸盐或可溶性钡盐,则式子不成立,错误;③根据溶液中电荷守恒和物料守恒得
c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-),2c(Na+)=3[c(S2-)+c(HS-)+ c(H2S)],两式结合消去c(Na+)即得,正确;④氨水与盐酸刚好完全中和时的产物是氯化铵,铵根离子水解,结合水电离产生的氢氧根离子使氢离子浓度大于氢氧根离子浓度,所以溶液中的氢离子也即水电离产生的氢离子,而水电离产生的氢离子与氢氧根离子浓度相等,所以c(OH-)=c(H+)=10-amol·L-1,正确,答案选C。
考点:考查溶液的稀释pH的计算、难溶盐的溶度积、守恒规律的应用、酸碱混合后的有关计算


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:单选题
25℃时,取浓度均为0.1 mol/L的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol/LNaOH溶液、0.1 mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是( )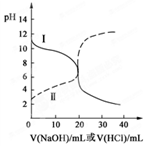
| A.曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅰ:滴加溶液到20 mL时: c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据水溶液中存在的平衡关系,判断下列说法正确的是
| A.往水中滴加少量氢氧化钠稀溶液,Kw变小 |
| B.往AgCl悬浊液中加入0.1mol·L-1NaI溶液,无明显现象产生 |
| C.室温下,稀释0.1mol·L-1的醋酸,溶液中c(CH3COO-)·c(H+)不变 |
| D.等体积等浓度的氨水与盐酸混合后所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4C1、③CH3COONH4、④NH3·H2O,c(NH4+)由大到小的顺序是:①>②>③>④ |
| B.某溶液中由水电离出的c( H+)=1×l0-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C.常温下,向AgCl悬浊液中加入少量NaC1固体后振荡,c(Cl-)增大,Ksp(AgCl)增大 |
| D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-) +c(HR-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
A.该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
B.pH=3的HA与pH=11的NaOH溶液等体积混合后:c(Na+)>c(A-)>c(OH-)>c(H+)
C.物质的量浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1HA溶液与0.05 mol·L-1NaOH溶液等体积混合后所得溶液中2c(H+)+c(HA)=c(A-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于各溶液的描述中正确的是 ( )。
| A.pH相等的①NH4Cl,②(NH4)2SO4,③NH4HSO4的溶液中,c(NH4+)大小:①=②=③ |
| B.常温下,在10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20 mL |
| C.向1.00 L 0.3 mol·L-1的NaOH溶液中缓慢通入CO2气体至溶液增重8.8 g,所得溶液中:3c(Na+)=2[c(HCO3—)+c(CO32—)+c(H2CO3)] |
| D.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A.0.2 mol/L CH3COONa溶液和0.1 mol/L HCl溶液等体积混合后:c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-) |
| B.pH=3的盐酸和NaNO3的混合溶液中:c(Na+)=c(Cl-) |
| C.0.1 mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D.物质的量浓度相等的HCN(弱酸)和NaCN溶液等体积混合后有:c(HCN)+2c(H+)=2c(OH-)+c(CN-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,水存在H2O H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
| A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B.将水加热,Kw增大,pH减小 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com