
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
|
第1组 |
第2组 |
第3组 |
|
S (单质) |
SO2、H2SO3、M、NaHSO3 |
SO3、H2SO4、Na2SO4、 NaHSO4 |
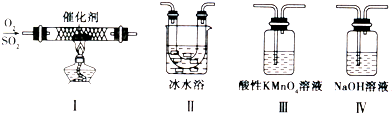
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。

(1)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
|
n(SO32—):n(HSO3—) |
91:9 |
1:1 |
9:91 |
|
pH |
8.2 |
7.2 |
6.2 |
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是 。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
|
序号 |
实验方案 |
实验现象 |
结论 |
|
方案① |
往第一份试液中加入KMnO4溶液溶液 |
紫红色褪去 |
SO2与Fe3+反应生成了Fe2+ |
|
方案② |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了Fe2+ |
|
方案③ |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了SO42— |
上述方案①得出的结论是否合理 ,原因 。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是 。
(15分)
Ⅰ.Na2SO3 (2分)
Ⅱ. (1)BD(2分) (2) AC (2分)
(3)否 (1分) SO2、Fe2+都能使酸性高锰酸钾溶液褪色(2分)
方案②:往第二份试液加入KSCN溶液,观察现象,再加入新制的氯水,(1分)先不变红,后溶液变红。(1分)
方案③:往第三份试液加入稀盐酸酸化,再加入BaCl2溶液(1分) 产生白色沉淀。(1分)
(4)B 中橙色(或黄色)褪去(2分)
【解析】
试题分析:
Ⅰ.第2组中硫元素都为+4价。
Ⅱ.(1)A、HNO3有挥发性,错误; B、可行;C、该方法不适合实验室使用,错误;D、可行
(2)A、符合电荷守恒,正确;B、C比较,当比值为10:1是,溶液呈碱性,说明SO32-浓度比 HSO3-大。
(3)SO2如果和Fe3+发生氧化还原产物为SO42-和Fe2+,因此需要检验这两个离子。
方案①不合理,SO2也能让高锰酸钾褪色。
(4)B 中橙色(或黄色)褪去,说明还原性小于SO2
考点:本题考查了实验的基本操作,溶液中三个守恒关系,实验方案设计等知识点,要求学生对实验的原理清楚。


科目:高中化学 来源: 题型:阅读理解
 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
| 0.12 |
| 28.12 |
| 0.12 |
| 28.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2015届安微省池州市高二上学期期中考试化学试卷试卷(解析版) 题型:填空题
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
|
第1组 |
第2组 |
第3组 |
|
S (单质) |
SO2、H2SO3、M、NaHSO3 |
SO3、H2SO4、Na2SO4、 NaHSO4 |
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。

(1)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
|
n(SO32—):n(HSO3—) |
91:9 |
1:1 |
9:91 |
|
pH |
8.2 |
7.2 |
6.2 |
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是 。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
|
序号 |
实验方案 |
实验现象 |
结论 |
|
方案① |
往第一份试液中加入KMnO4溶液溶液 |
紫红色褪去 |
SO2与Fe3+反应生成了Fe2+ |
|
方案② |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了Fe2+ |
|
方案③ |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了SO42— |
上述方案①得出的结论是否合理 ,原因 。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com