
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
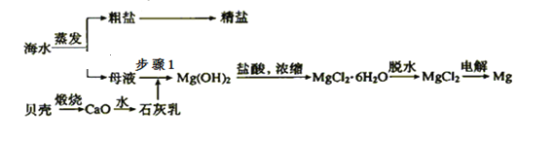
Ⅰ.(1)上述过程中没有涉及到的四大基本反应类型是______;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤1中分离操作的名称是___________;
(3)粗盐中含有Ca2+、Mg2+、SO42—等杂质,精制时所用试剂为:a.盐酸;b.BaCl2溶液;c.NaOH溶液;d.Na2CO3溶液。加入试剂的顺序是_________________________________;
II.实验室利用精盐配制480mL 2.0mol·L-1NaCl溶液。
(4)除容量瓶外,还需要的玻璃仪器有___________________;
(5)用托盘天平称取固体NaCl________g;
(6)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀
⑧装瓶。操作中还缺少一个重要步骤是______________________;
(7)下列错误操作可使所配制氯化钠溶液浓度偏低的是_________。
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
【答案】c 过滤 bdca或cbda或bcda 烧杯、玻璃棒、胶头滴管 58.5 洗涤(烧杯和玻璃棒) bd
【解析】
Ⅰ.(1)煅烧贝壳生成CaO的反应方程式为:CaCO3![]() CaO+CO2
CaO+CO2![]() 、MgCl2·6H2O分解生成MgCl2以及MgCl2电解生成Mg,都属于分解反应;CaO溶于水的反应方程式为:CaO+H2O===Ca(OH)2,属于化合反应;步骤1Ca(OH)2和MgCl2反应生成Mg(OH)2和CaCl2是复分解反应,盐酸溶解氢氧化镁的反应为:Mg(OH)2+2HCl===MgCl2+2H2O属于复分解反应;故没有涉及到置换反应,答案为c;
、MgCl2·6H2O分解生成MgCl2以及MgCl2电解生成Mg,都属于分解反应;CaO溶于水的反应方程式为:CaO+H2O===Ca(OH)2,属于化合反应;步骤1Ca(OH)2和MgCl2反应生成Mg(OH)2和CaCl2是复分解反应,盐酸溶解氢氧化镁的反应为:Mg(OH)2+2HCl===MgCl2+2H2O属于复分解反应;故没有涉及到置换反应,答案为c;
(2)步骤1中分离难溶性固体和液体,故该操作为过滤;
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,可先加入过量的BaCl2溶液,除去溶液中SO42-,再加入过量Na2CO3溶液,除去溶液中的Ba2+、Ca2+,再加入过量的NaOH溶液,除去溶液中的Mg2+,再加入适量的盐酸,除去溶液中过量的NaOH和Na2CO3,加入顺序为bdca;加入顺序还可以是cbda或bcda,无论何种加入顺序,适量盐酸需最后加入,以除去溶液中的NaOH和Na2CO3,以达到不引入新杂质的原则;
II.(4)该实验中需要的玻璃仪器有玻璃棒、烧杯、容量瓶、胶头滴管,所以还需要烧杯、玻璃棒、胶头滴管;
(5)该实验选用的容量瓶为500mL容量瓶,故需要称取固体NaCl的质量![]() ;
;
(6)一定物质的量浓度溶液的配制的操作顺序为计算、称量、溶解并冷却、转液、洗涤并转液、定容、摇匀、装瓶,故缺少的步骤是洗涤;
(7)a.容量瓶洗净后残留了部分的水,因后续需要加入蒸馏水,故对配制氯化钠溶液浓度无影响;
b.转移时溶液溅到容量瓶外面,会导致溶质的量减少,配制氯化钠溶液浓度将偏低;
c.定容时俯视容量瓶的刻度线,会导致溶液体积偏小,配制氯化钠溶液浓度将偏高;
d.摇匀后见液面下降,再加水至刻度线,会导致溶液体积偏大,配制氯化钠溶液浓度将偏低;故答案为bd。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、 F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1) B元素符号为____,A与C以原子个数比为1:1形成的化合物的电子式为___,用电子式表示C与E形成化合物的过程____, D形成的简单离子的结构示意图为____。
(2) F的氢化物是由____(极性或非极性)键形成的分子,写出实验室制备该氢化物的化学方程式____。
(3) 非金属性D____E(填大于或小于),请从原子结构的角度解释原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO2 与SO2 以体积比1:2 置于恒容密闭容器中发生反应:![]() 。下列能说明该反应达到平衡状态的是
。下列能说明该反应达到平衡状态的是
A. v(SO3 ) = v(NO2 ) B. 混合气体的密度保持不变
C. 混合气体的颜色保持不变 D. 每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:

试回答下列问题:
(1)试剂X为__________;
(2)操作Ⅰ、操作Ⅱ均为_____________(填操作名称),在实验室进行该操作时需要的玻璃仪器有__________________________________;
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为_______________________________,请举一例该反应的用途________________________;
(4)反应Ⅱ的离子方程式为____________________________________________________;
(5)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
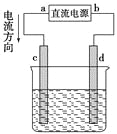
A. a为负极,b为正极
B. a为阳极,b为阴极
C. 电解过程中,d电极质量增加
D. 电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(气)![]() bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增加了 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、CO、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态CO原子的价电子排布式为____________,Co3+核外3d能级上有_________对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co+ 的配位数是______________,1mol 配离子中所含σ键的数目为_____________,配位体N3-中心原子杂化类型为____________________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+ ,其原因是___________________。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________,立方体中Fe2+间连接起来形成的空间构型是_____________________。
(5)NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国的四大发明之一,深受世人称赞,其反应原理为:
S+3C+2KNO3![]() N2↑+3CO2↑+K2S
N2↑+3CO2↑+K2S
请回答下列相关问题:
(1)当产生0.1molN2时,反应中共转移电子数为_____,还原剂的物质的量为_____mol。
(2)若生成标准状况下33.6LCO2,则被S氧化的C的物质的量是_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
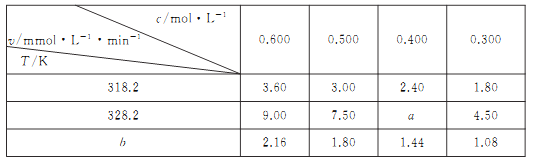
A. a=6.00 B. 同时改变反应温度和蔗糖的浓度,v可能不变
C. b>318.2 D. 不同温度时,蔗糖浓度减少一半所需的时间不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com