
实验装置如下图:
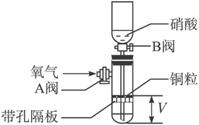
实验步骤如下:
在实验装置的隔板上铺一层铜粒,打开A、B阀门,通入氧气,排除空气。关闭A、B阀,撤去氧气源。在漏斗中加入预先量好的硝酸,体积等于V(见上图),刚够淹没铜粒。先打开B阀,再打开A阀,让硝酸顺着漏斗颈流入试管,当硝酸与铜粒接触时马上关闭A阀。细心观察漏斗颈(以下称内管)中液面高低和试管(以下称外管)中溶液颜色及液面上方气体颜色的变化。
(1)描述观察到的实验现象
①_______________________________________________________________。
②_______________________________________________________________。
③_______________________________________________________________。
(2)写出实验过程中发生反应的化学方程式
①_______________________________________________________________。
②_______________________________________________________________。
③_______________________________________________________________。
(3)如果测得反应开始时液封内的气体体积是V1,反应结束后液封内的气体体积是V2(气体体积均已换算成标准状况),则反应后生成硝酸铜的物质的量是____________mol。
(1)①外管中的液面下降,内管中的液面上升,然后反复进行,直至反应停止(即产生振荡现象)
②外管中有气体产生,液面上出现棕红色气体,然后消失,再产生再消失,直至反应停止(即产生振荡现象)
③外管中溶液变为蓝色
(2)①3Cu+8HNO3(稀)====3Cu(NO3)+2NO↑+4H2O
②2NO+O2====2NO2
③3NO2+2H2O====2HNO3+NO
(3)(4V1+3V2)/44. 8
解析:铜与硝酸反应时,生成一氧化氮气体,气体聚集于试管上方,于是将硝酸压入内管,暂时停止反应。由于外管中的NO、O2和H2O发生反应,致使气体的压强减小,外管内液面又上升,与铜再次接触,于是又发生反应,生成的NO再与O2和水反应,如此循环往复,直到硝酸消耗完全。从整个过程看,外管内的液面上升、下降,上升、下降,如此反复,就产生了振荡现象。
要计算生成硝酸铜的物质的量,必须弄清反应后液面上方的气体的组成。由于铜和硝酸都是足量的,所以最后的气体应为一氧化氮。也就是说,发生的反应有两种类型:2Cu+4HNO3+O2====2Cu(NO3)2+2H2O,3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O,第一个反应,可以利用O2的体积为V1,求出Cu(NO3)2的物质的量为V1/11.2 mol;第二个反应中,可利用NO的体积为V2,求出Cu(NO3)2的物质的量为3V1/44.8 mol,从而得出生成Cu(NO3)2的物质的量共为(4V1+3V2)/44.8 mol。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:阅读理解
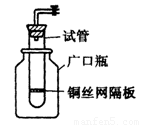
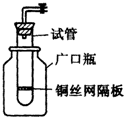 (1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体
(1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体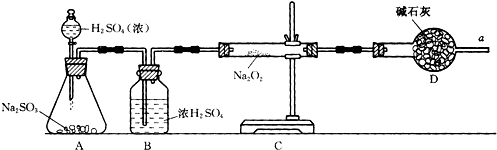
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 16(w-m) |
| n-w |
| 16(w-m) |
| n-w |
查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)(1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体_________________(答2种即可);
若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体________,写出反应的离子方程式_______________。
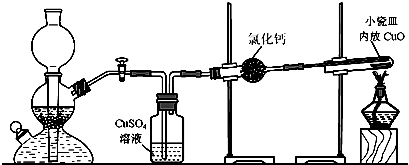
(2)①写出CO2和Na2O2反应的化学方程式______________________。
②某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断是否合理_______,(填“是或否”)简要说明理由:______________________。
③该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验。
装置中B的作用是_______________,D的作用是_______________。
④为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________。
A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧.
B.将C装置中反应后的固体物质溶于适量水配成溶液.
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成.
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
查看答案和解析>>
科目:高中化学 来源:09-10学年延安实验中学高一下学期期中考试化学卷 题型:实验题
(11分)(1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体_________________(答2种即可);
若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体________,写出反应的离子方程式_______________。
(2)①写出CO2和Na2O2反应的化学方程式______________________。
②某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断是否合理_______,(填“是或否”)简要说明理由:______________________。
③该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验。
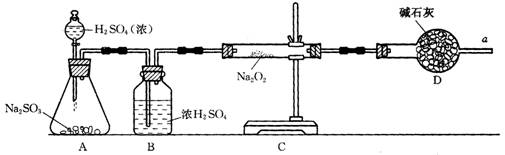
装置中B的作用是_______________,D的作用是_______________。
④为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________。
A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧.
B.将C装置中反应后的固体物质溶于适量水配成溶液.
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成.
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com