
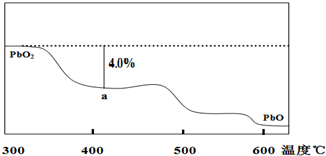
 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题:
| ||
| 2-x |
| 2 |
| 8.0g |
| 100g/mol |
| 12.42g |
| 207g/mol |
| 2x |
| 4 |
| x |
| 2 |
| (1-x)×2 |
| 2 |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| ||
| 2-x |
| 2 |
| 2-x |
| 2 |
| 2m+n |
| m+n |


科目:高中化学 来源: 题型:
| A、0.09 | B、0.11 |
| C、0.06 | D、0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、重结晶法一般适用于被提纯的有机物在溶剂中的溶解度受温度影响较大的混合物的分离 |
| B、对有机物分子红外光谱图的研究有助于确定有机物相对分子质量 |
| C、燃烧法是确定有机物分子官能团的有效方法 |
| D、质谱法通常用于分析确定有机物分子的元素组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 80℃,通电 |
| Ⅰ |
| 室温,KCl |
| Ⅱ |
| Cl2 |
| 460℃ |
| 蒸馏 |
| H2 |
| 1100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
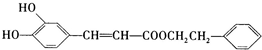 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: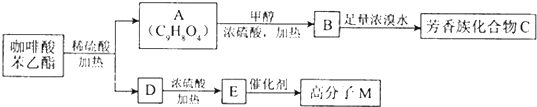
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁粉和氯化铁溶液反应 Fe+Fe3+═Fe2+ |
| B、铁和稀盐酸反应 Fe+2H+═Fe2++H2↑ |
| C、氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| D、铝和氢氧化钠溶液反应 2Al+2OH-=2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若大量浓硫酸洒在皮肤上应立即用纱布拭去,再用大量水冲洗 |
| B、稀释时要将水沿器壁慢慢倒入浓硫酸中,并用玻璃棒不断搅拌 |
| C、欲除去NH3中的H2O,可让混合气体通过盛有浓硫酸的洗气瓶 |
| D、浓硫酸不分解,不挥发,所以能敞口放置在空气中,质量不会发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com