
【题目】醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)===ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)===2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)===[Cr(CH3COO)2]2·2H2O(s)
请回答下列问题:
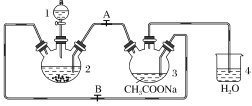
(1)仪器1的名称是________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是________(选下面字母);目的是__________________________________________________________________。
A、盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭止水夹________(填“A”或“B”,下同),打开止水夹________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是____________________________。(用离子方程式表示)
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51 g,取用的醋酸钠溶液为1.5 L 0.1 mol·L-1;实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.48 g,则该实验所得产品的产率为________(不考虑溶解的醋酸亚铬水合物)。
【答案】分液漏斗C让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化BA2Cr3++Zn==2Cr2++Zn2+ (使锌与CrCl3充分反应得到CrCl2)84.0%
【解析】
(1)根据仪器结构特征,可以知道仪器1为分液漏斗;
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出;
(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合;
(4)过量的锌与CrCl3充分反应得到CrCl2;
(5) CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可以知道CH3COONa足量,根据CrCl2计算[Cr(CH3COO)2]2·2H2O的理论产量,进而计算其产率。
(1)根据仪器结构特征,可以知道仪器1为分液漏斗,
因此,本题正确答案是:分液漏斗;
(2) 价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,
因此,本题正确答案是:C;让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化;
(3) 利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A,
因此,本题正确答案是:B;A;
(4)锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2,离子方程式为:2Cr3++Zn==2Cr2++Zn2+ ,
因此,本题正确答案是:2Cr3++Zn==2Cr2++Zn2+ ;
(5) CrCl3为![]() =0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)===[Cr(CH3COO)2]2·2H2O(s)
=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)===[Cr(CH3COO)2]2·2H2O(s)
可以知道CH3COONa足量,则得到[Cr(CH3COO)2]2·2H2O为0.06mol ![]() 376g/mol=11.28g,
376g/mol=11.28g,
所得产品的产率为:![]() ×100%=84.0%,
×100%=84.0%,
因此,本题正确答案是:84.0%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学键的描述说法正确的是( )
①水分子间以共价键相结合成为冰 ②金属和非金属元素只能形成离子键
③离子键是阳离子、阴离子的相互吸引 ④两个非金属原子间不可能形成离子键
⑤所有物质中一定含有化学键
A. ①②⑤ B. 都不正确 C. ④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A. x=1
B. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
C. 平衡时A的浓度为1.50 mol·L-1
D. B的转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且书写正确的是
A. 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 碱性镉镍可充电电池的正极反应:NiO(OH)-e-+H2O==Ni(OH)2+OH-
C. AgOH沉淀溶于氨水:AgOH+2NH3·H2O==[Ag(NH3)2]++OH-+2H2O
D. 已知苯甲酸的酸性比碳酸强,向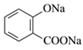 溶液中通入过量CO2:
溶液中通入过量CO2: +2CO2+2H2O—→
+2CO2+2H2O—→![]() +2HCO
+2HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如图所示三套实验装置:

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是____。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是________________,说明该反应属于____(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_______________________
②若观察到烧杯里产生气泡,则说明M溶于水__________(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是____。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O![]() 4KOH+3O2↑)是放热反应还是吸热反应。
4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置____(填“I”“Ⅱ”或“Ⅲ”)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是____(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.关于该电池的叙述正确的是( )

A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在烧杯中加入水和煤油(密度:约0.8gcm﹣3)各50mL。将一小粒金属钠投入该烧杯中(钠的密度:0.97gcm﹣3)。可能观察到的现象是( )
A.钠在水层中反应并四处游动
B.钠停留在煤油层中不发生反应
C.钠在煤油的液面上反应并四处游动
D.钠在煤油与水的界面处反应并可能作上下跳动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com