
| H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2 |
| Ka2=5.6×10-11 | Ka2=5.42×10-5 |
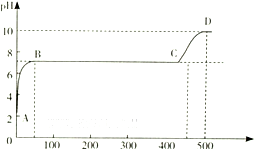
| 10-14 |
| 10-10 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
| 电解质 | HF | CH3COOH | HNO2 | NH3?H2O |
| 电离平衡常数K | 3.53×10-4 | 1.76×10-5 | 4.6×10-4 | 1.77×10-5 |
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

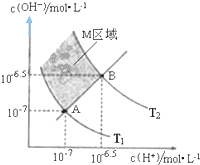
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.中和时所需NaOH的量 | B.c(H+) |
| C.c(OH-) | D.c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,NaA溶液的pH=9 |
| B.0.01mol?L-1HA溶液的pH=4 |
| C.pH=2的HA溶液稀释100倍后pH=3.5 |
| D.HA溶液跟锌反应,放出H2很慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用HNO2溶液作导电试验,灯光较暗 |
| B.HNO2是共价化合物 |
| C.亚硝酸不与氯化钠反应 |
| D.常温下0.1mol?L-1亚硝酸溶液的c(H+)为7.1×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol?L-1氨水,溶液的pH=13 |
| B.0.1mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C.0.1mol?L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D.0.1mol?L-1醋酸与0.1mol?L-1 NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| C.25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)> V(NaOH) |
| D.AgCl易转化为AgI沉淀且KSP(AgX)=c(Ag+)? c(X?),故KSP(AgI) > KSP(AgCl) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com