
【题目】一定条件下对于可逆反应![]() ,若X、Y、Z三种气体的初始浓度和平衡浓度如下表(c1、c2、c3均不为零):
,若X、Y、Z三种气体的初始浓度和平衡浓度如下表(c1、c2、c3均不为零):
物质 | X | Y | Z |
初始浓度(mol·L-1) | c1 | c2 | c3 |
平衡浓度(mol·L-1) | 0.2 | 0.3 | 0.12 |
则下列判断正确的是( )
A.c1∶c2=2∶3
B.平衡时Y和Z的生成速率之比为2∶3
C.X、Y的转化率之比为2:3
D.c1的取值范围为0<c1<0.3
【答案】A
【解析】
①若反应一开始正向进行
![]()
起始浓度(mol·L-1) c1 c2 c3
转化浓度(mol·L-1) 2x 3x 2x
平衡浓度(mol·L-1) c1-2x c2-3x c3+2x
 ,解得
,解得![]() =
=![]() ;c1、c2、c3均不为零且均大于0,故0<x<0.06,可推出0.2<c1<0.32;
;c1、c2、c3均不为零且均大于0,故0<x<0.06,可推出0.2<c1<0.32;
②若反应一开始逆向进行
![]()
起始浓度(mol·L-1) c1 c2 c3
转化浓度(mol·L-1) 2x 3x 2x
平衡浓度(mol·L-1) c1+2x c2+3x c3-2x
 ,解得
,解得![]() =
=![]() ;c1、c2、c3均不为零且均大于0,可推出0<c1<0.2;
;c1、c2、c3均不为零且均大于0,可推出0<c1<0.2;
③若反应一开始就处于平衡状态,则c1=0.2mol/L,c2=0.3mol/L;
A、由上述分析可知,无论反应一开始正向进行还是逆向进行或者处于平衡状态,![]() 均为
均为![]() ,故A正确;
,故A正确;
B、速率之比等于化学计量数之比,则平衡时Y和Z的生成速率之比为3:2,故B错误;
C、转化率=![]() ×100%,X、Y的转化量、开始的量均为2:3,则X、Y的转化率之比为1:1,故C错误;
×100%,X、Y的转化量、开始的量均为2:3,则X、Y的转化率之比为1:1,故C错误;
D、综上所述,c1的取值范围为0<c1<0.32,故D错误。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列有关数据的比较,不正确的是()
A.元素的价电子数总等于所在族的族序数
B.NaOH晶体中阳离子和阴离子数目相等
C.CsCl晶体中每个![]() 周围紧邻的
周围紧邻的![]() 和每个
和每个![]() 周围紧邻的
周围紧邻的![]() 个数相等
个数相等
D.![]() 中的N原子数与配位键数相等
中的N原子数与配位键数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是 ( )
A. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
B. 金刚石为空间网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
C. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
D. 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界稀土资源大国,稀土元素是镧系、钪![]() 、钇
、钇![]() 种元素的总称,它们位于元索周期表中同一副族。
种元素的总称,它们位于元索周期表中同一副族。
![]() 原子的价层电子排布式为______,第一电离能Sc______Y
原子的价层电子排布式为______,第一电离能Sc______Y![]() 填“大于”或“小于”
填“大于”或“小于”![]() 。
。
![]() 是生产铈的中间化合物,它可由氟碳酸铈
是生产铈的中间化合物,它可由氟碳酸铈![]()
![]() 精矿制得:
精矿制得:
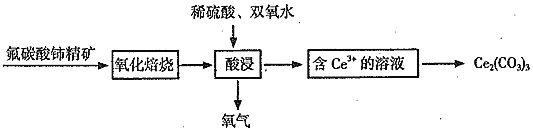
![]() 中,Ce的化合价为______。
中,Ce的化合价为______。
![]() 氧化焙烧生成二氧化铈
氧化焙烧生成二氧化铈![]() ,其在酸浸时发生反应的离子方程式为______。
,其在酸浸时发生反应的离子方程式为______。
![]() 离子的立体构型的名称为______,中心原子的杂化方式为______,分子或离子中的大
离子的立体构型的名称为______,中心原子的杂化方式为______,分子或离子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如苯分子中的大
如苯分子中的大![]() 键可表示为
键可表示为![]() ,则
,则![]() 中的大
中的大![]() 键应表示为______。
键应表示为______。
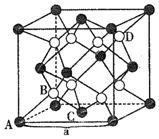
![]() 常温、常压下
常温、常压下![]() 是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。
是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。![]() 晶胞是立方萤石型,则铈离子的配位数为______,如图中离子坐标参数
晶胞是立方萤石型,则铈离子的配位数为______,如图中离子坐标参数![]() 0,
0,![]() ;
;![]() :
:![]() ,若将B选为晶胞顶点坐标参数
,若将B选为晶胞顶点坐标参数![]() 0,
0,![]() ,则D离子处于______位置,坐标参数为______。已知该晶胞的棱长
,则D离子处于______位置,坐标参数为______。已知该晶胞的棱长![]() ,其密度为______
,其密度为______![]() 列出计算式即可
列出计算式即可![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室电解法制备LiOH,其工作原理如图所示,下列说法不正确的是( )

A.X电极连接电源正极
B.M为阴离子交换膜
C.Y电极反应式为![]()
D.制备2.4gLiOH产生的H2在标准状况下为1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一原电池工作原理示意图,电池工作过程中左右两烧杯所盛放的溶液中不允许引入杂质。下列有关说法中正确的是( )

A.所用离子交换膜为阳离子交换膜
B.Cu电极的电极反应为Cu-2e-=Cu2+
C.电池工作过程中,CuCl2溶液浓度降低
D.Fe为负极,电极反应为Fe2++2e-=Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是合成新农药的重要中间体。以化合物A为原料合成化合物G的工艺流程如下:

(1)化合物G中含氧官能团的名称为________。
(2)反应D→E的反应类型为________。
(3)化合物B的分子式为C7H6Cl2,B的结构简式为______。
(4)写出同时满足下列条件的G的一种同分异构体的结构简式:______。
①能发生银镜反应;
②核磁共振氢谱显示氢原子的峰值比为3∶2∶2∶1。
(5)请以化合物F和CH2(COOC2H5)2为原料制备 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Ksp[(CH3)2NH)]=l.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定二甲胺溶液的曲线
B. a点溶液中:c[(CH3)2NH2+]>c[CH3]2NH·H2O]
C. d点溶液中:c(H+)=c(OH-)+c[CH3]2NH·H2O]
D. b、c、e三点的溶液中,水的电离程度最大的是b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com