
����Ŀ������˵���д�����ǣ� ��
A.��A��g��+B��g��![]() C��g����H��0��������Ӧ�Ļ��С���淴Ӧ�Ļ��
C��g����H��0��������Ӧ�Ļ��С���淴Ӧ�Ļ��
B.�Ʊ���������ʱ�����ȵ�NaOH��Һ�ռ������Գ�ȥ���е�����
C.�����������Ӧ�뱽�����ᷴӦ�����������ķ�Ӧ������ͬ
D.��֪ij�¶���Ksp��Ag2S��=6��10һ50��Ksp��AgC1���T2��l0һ10����2AgCl��s��+S2����aq��![]() Ag2S��s��+2C1����aq����ƽ�ⳣ��ԼΪ6.7��1029
Ag2S��s��+2C1����aq����ƽ�ⳣ��ԼΪ6.7��1029
���𰸡�B
��������
A����Ϊ��H=����Ӧ�Ļ��-�淴Ӧ�Ļ��<0����������Ӧ�Ļ��С���淴Ӧ�Ļ�ܣ�ѡ��A��ȷ��
B�������������ȵ�NaOH��Һ�лᷢ��ˮ�⣬Ӧ���ñ���̼������Һ�ռ������Գ�ȥ���е����ᣬѡ��B����
C��������������Ӧ����һ�ȼ���ȣ���������ԭ�ӱ���ԭ��ȡ�����������ᷴӦ���е���ԭ�ӱ�����ȡ��������������������ȡ����Ӧ��ѡ��C��ȷ��
D��2AgCl��s��+S2-��aq��Ag2 S��s��+2C1- ��aq����ƽ�ⳣ��K=![]() =
= =
=![]() =6.7��1029��ѡ��D��ȷ��
=6.7��1029��ѡ��D��ȷ��
��ѡB��


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����. ��1����пƬ��ͭƬ���Ӻ����ϡ������Һ�У�������ԭ��أ�����һ��ʱ�䣬пƬ������������3.25g��ͭ��������������________L����״���£���������ͨ��________mol���ӡ�
��2�� ��ag NaͶ�뵽bg D2O���������У���Ӧ��������Һ���ܶ�Ϊdg/cm3�������Һ���ʵ���Ũ����_______��
��. ������A��B���ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A��g����B��g��2C��g����2D��g������Ӧ���е�10 sĩʱ�����A�����ʵ���Ϊ1.8 mol��B�����ʵ���Ϊ0.6 mol��C�����ʵ���Ϊ0.8 mol����
��1����C��ʾ10 s������Ӧ��ƽ����Ӧ����Ϊ____________��
��2����ӦǰA�����ʵ���Ũ����________��
��3��10 sĩ��������D��Ũ��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڲ�ͬ�ܼ�����NaOH������ͬ���͵ķ�Ӧ�����ɲ�ͬ�ķ�Ӧ���
��1��д����������NaOHˮ��Һ���ȵķ�Ӧ����ʽ��_______________��ijͬѧȡ������������NaOHˮ��Һ��Ӧ��Ļ����Һ�������еμ�AgNO3��Һ�����ȣ�����������������ͬѧ�ɴ˵ó���������NaOHˮ��Һ��Ӧ���������廯�ƣ�����Ϊ�Ƿ������ԭ��____________________��
��2��д����������NaOH�Ҵ���Һ���ȵķ�Ӧ����ʽ��________����Ӧ�����ɵ������������ͼ��ʾװ�ü��飬������______��ˮ�������� ______��

��3����ϩʹ��ˮ��ɫ�Ļ�ѧ����ʽ�� __________________________��X�DZ���ϩ��Է���������14����ϩ��ͬϵ���ҵ����X�������ϵĻ�ѧ����ʽΪ��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ˮ������Ӧ�IJ����Ǻϳɼ״���ԭ�ϣ�CH4��H2O![]() CO��3H2
CO��3H2
��֪��CO��2H2![]() CH3OH��CO2��3H2
CH3OH��CO2��3H2![]() CH3OH��H2O��300 mol CH4��ȫ��Ӧ��IJ����У�����100 mol CO2��ϳɼ״�������ü״�350 mol����������120 mol������CO2��ת����_________��
CH3OH��H2O��300 mol CH4��ȫ��Ӧ��IJ����У�����100 mol CO2��ϳɼ״�������ü״�350 mol����������120 mol������CO2��ת����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
п�ڹ�ҵ������Ҫ���ã�Ҳ������������Ԫ�ء��ش��������⣺
��1��Znԭ�Ӻ�������Ų�ʽΪ________________��
��2����ͭ����������ʹ�õĺϽ�֮һ����Ҫ��Zn��Cu��ɡ���һ��������1��Zn��_______��1��Cu)(����ڡ���С�ڡ�)��ԭ����________________��
��3��ZnF2���нϸߵ��۵㣨872 ��)���仯ѧ��������_________��ZnF2�������л��ܼ���ZnCl2��ZnBr2��ZnI2�ܹ������Ҵ������ѵ��л��ܼ���ԭ����________________��
��4�����л����ݡ�����ҽ�伮�У�������¯��ʯ��ZnCO3����ҩ������������Ƥ����֢����洴�ˡ�ZnCO3�У������ӿռ乹��Ϊ________________��Cԭ�ӵ��ӻ���ʽΪ________________��
��5������Zn�����е�ԭ�Ӷѻ���ʽ��ͼ��ʾ�����ֶѻ���ʽ��Ϊ_______________���������ױ߱߳�Ϊa cm����Ϊc cm�������ӵ�������ֵΪNA��Zn���ܶ�Ϊ________________g��cm��3���г�����ʽ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2S2O5�dz��õķ�������Ư�����������̵����е�SO2����Na2S2O5�����������£�
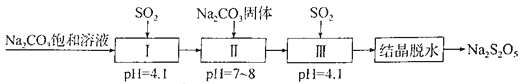
����˵����ȷ����
A. �����Ʊ��������漰��������ֻ��һ������������
B. Na2S2O5����������SO2��Ư��ʱ�������ֻ�ԭ��
C. ���������е�Na2CO3������Һ��Na2CO3���岻�ɻ���
D. ʵ����ģ�����ᾧ��ˮ��ʱ�õ�������ֻ���������������ձ���©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС������H2C2O4��Һ�������ữ��KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ��ʱͨ���ⶨ����KMnO4��Һ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�������֪��2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O
ʵ���� | 0.1mol/L����KMnO4��Һ�����/mL | 0.6mol/LH2C2O4��Һ�����/mL | H2O�����/mL | ʵ���¶�/�� | ��Һ��ɫ����ʱ��/min |
�� | 10 | V1 | 35 | 25 | |
�� | 10 | 10 | 30 | 25 | |
�� | 10 | 10 | V2 | 50 |
��1������V1=_______mL��V2=_______mL��
��2��̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________��
��3��ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ2min�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(H2C2O4)��________mol��L��1��min��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

(1)����ȼ�ϵ�ص�����ת����Ҫ��ʽ��______���ڵ����е�����������Ϊ___________(��a��b ��ʾ)��
(2)������ӦʽΪ_____________��
(3)�缫����Ʋ��۵�ԭ��Ϊ______________________________��
(4)�õ�ع���ʱ��H2��O2�������ⲿ��������ؿ����������ṩ���ܡ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
��.2Li+H2![]() 2LIH
2LIH
��.LiH+H2O=LiOH+H2��
����Ӧ���еĻ�ԭ����_________����Ӧ���е���������_________��
����֪LiH�����ܶ�Ϊ0.82g/cm3���������224L(��״��)H2�����ɵ�LiH����뱻���յ�H2�����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ļ�����������ʵ�飺
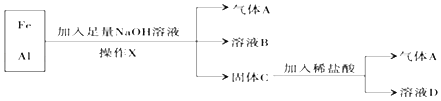
(1)����X��������_____��
(2)����A��_____ (�ѧʽ )��
(3)��������NaOH��Һʱ������Ӧ�����ӷ���ʽΪ��_____������ϡ���ᷢ����Ӧ�����ӷ���ʽΪ��_____��
(4)����ҺD����NaOH��Һ���۲쵽�����İ�ɫ��״����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ����д������ת���Ļ�ѧ����ʽ��_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com