
【题目】利用太阳能光伏电池电解水获得H2,工作示意图如图。下列分析不正确的是( )
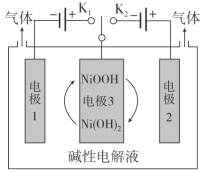
A.控制开关连接K1,电极1发生反应:2H2O+2e-=H2↑+2OH-
B.控制开关连接K2,电极3附近溶液的pH减小
C.通过控制开关连接K1或K2,可交替得到H2和O2
D.电极3的主要作用是通过NiOOH和Ni(OH)2相互转化实现电子转移
【答案】B
【解析】
当控制开关连接K1,电极1连接电源的负极,作阴极,溶液中的H2O得到电子,电极方程式为2H2O+2e-=H2↑+2OH-,电极3作阳极,发生氧化反应,Ni(OH)2转化为NiOOH,电极方程式为Ni(OH)2-e-+OH-=NiOOH+H2O。当控制开关连接K2,电极2连接电源的正极,作阳极,溶液中的OH-失电子,电极方程式为4OH--4e-=O2↑+2H2O;电极3作阴极,NiOOH转化为Ni(OH)2,电极方程式为NiOOH+e-+H2O=Ni(OH)2+OH-。
A.当控制开关连接K1,电极1连接电源的负极,作阴极,溶液中的H2O得到电子,电极方程式为2H2O+2e-=H2↑+2OH-,A正确,不选;
B.当控制开关连接K2,电极3作阴极,NiOOH转化为Ni(OH)2,电极方程式为NiOOH+e-+H2O=Ni(OH)2+OH-,电极附近产生OH-,pH增大,B错误,符合题意;
C.当控制开关连接K1时,电极1处H2O得到电子得到H2,当控制开关连接K2时,电极2处OH-失去电子得到O2,因此通过控制开关连接K1或K2,可交替得到H2和O2,C正确,不选
D.当控制开关连接K1,Ni(OH)2转化为NiOOH;当控制开关连接K2,NiOOH转化为Ni(OH)2。电极3处NiOOH和Ni(OH)2相互转化实现了电子转移,D正确,不选;
答案选B。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】锂电池应用广泛,大致可分为锂金属电池和锂离子电池。锂离子电池工作原理:以石墨/锂钴氧电池为例,其总反应方程式为:LiCoO2+6C![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
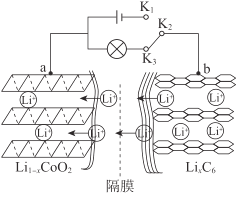
试回答下列问题:
(1)连接K1、K2时,a作___极。
(2)连接K2、K3时,被还原的物质是___。
(3)放电时,负极发生反应的电极反应式是___。
(4)锂离子电池的电极废料(含LiCoO2)中的金属可回收利用。
①将电极废料磨碎后用酸浸出,磨碎的目的是___。
②将电极废料用盐酸浸出,得到含Li+、Co2+的溶液,并有黄绿色气体生成,则该反应的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。

下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如图:
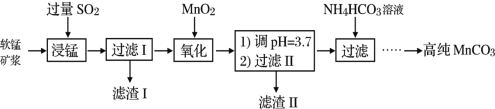
(1)为了提高“浸锰”过程中原料的浸出率,可以采取的措施有___(写一条。)
(2)浸锰过程中Fe2O3与SO2反应的化学方程式为:Fe2O3+SO2+2H+=2Fe2++SO![]() +H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
+H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
(3)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___(填离子符号)。
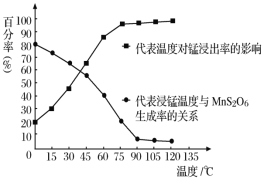
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___。
(5)写出“氧化”过程中MnO2与SO2反应的化学方程式___。
(6)滤渣Ⅱ是___(填化学式)。
(7)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.100mL1mol/LAl2(SO4)3溶液中,所含Al3+的数目为0.2NA
B.100mL1mol/L氨水中,所含NH![]() 的数目为0.1NA
的数目为0.1NA
C.将1molN2和3molH2充入密闭容器,一定条件下充分反应,得到2NA个NH3分子
D.已知2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol,若反应放出242kJ热量,则形成2NA个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的富集与转化是当今环境研究的热点。
(1)化石燃料的燃烧是使大气CO2浓度增加的原因之一。汽油中含有辛烷(C8H18),1molC8H18(l)完全燃烧生成CO2(g)和H2O(l),放出5518kJ热量。写出C8H18完全燃烧的热化学方程式:__。
(2)一种富集CO2的过程如图所示。
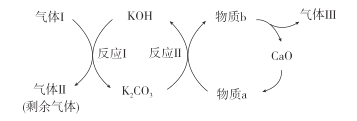
①气体Ⅰ、Ⅱ、Ⅲ中,CO2浓度最高的是___。
②反应Ⅱ的化学方程式是__。
(3)一定条件下,CO2和H2反应能生成C2H4,实现CO2向能源物质的转化。
已知:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH<0
①上述反应的ΔH可根据C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)和__反应的焓变计算。
②研究温度和压强对CO2的平衡转化率的影响,结果如图所示。
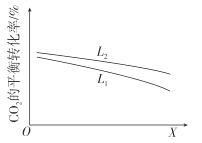
X代表的物理量是__。比较L1与L2的大小,并说明依据__。
③相同条件下,CO2和H2还能发生其它反应:
反应a:CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
反应b:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
……
Fe和Co(钴)可作为该反应的催化剂。改变铁钴的物质的量比,测定相同时间内CO2的消耗率和含碳产物的占比,结果如下:
n(Fe):n(Co) | CO2消耗率/% | 含碳产物占比/% | ||
CO | C2H4 | CH4 | ||
100:0 | 1.1 | 100 | 0 | 0 |
50:50 | 30.5 | 36.8 | 20.3 | 42.9 |
0:100 | 69.2 | 2.7 | 0.2 | 97.1 |
结合数据,推测催化剂中钴的作用:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图所示装置测定水中氢氧元素之比。下列说法错误的是

A.①、③、④中依次盛装无水CaCl2、碱石灰、碱石灰
B.需测定实验前后装置②和装置③的质量差
C.结束反应时,应先移走酒精灯,待装置②的玻璃管冷至室温,再关闭活塞K
D.实验后装置②的玻璃管中CuO未全部变红,对实验结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末X中可能含有K2SO4、(NH4)2CO3、K2SO3、NaNO3、Cu2O、FeO、Fe2O3中的若干种。某同学为确定该固体粉末的成分,取X进行如下实验,实验过程及现象如图所示。该同学得出的结论不正确的是( )

已知:Cu2O+2H+=Cu2++Cu+H2O
A.根据现象1无法推出固体粉末中是否含有NaNO3
B.根据现象2可推出白色沉淀是BaSO4
C.根据现象3可推出固体粉末中一定含有K2SO3
D.根据现象4可推出固体粉末中的氧化物只有FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型电池的工作原理如图所示。该电池工作时,下列说法错误的是
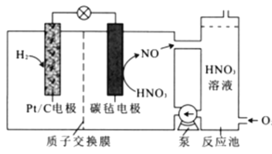
A.Pt/C电极为负极,质子通过交换膜从负极区移向正极区
B.理论上,当消耗22.4L(标准状况下)H2时,会消耗1molO2
C.反应池中发生总反应4NO+3O2+2H2O=4HNO3,实现HNO3再生
D.正极的电极反应为NO3-+4H++3e-=NO↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com