
【题目】一种新型电池的工作原理如图所示。该电池工作时,下列说法错误的是
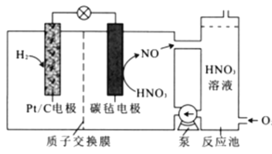
A.Pt/C电极为负极,质子通过交换膜从负极区移向正极区
B.理论上,当消耗22.4L(标准状况下)H2时,会消耗1molO2
C.反应池中发生总反应4NO+3O2+2H2O=4HNO3,实现HNO3再生
D.正极的电极反应为NO3-+4H++3e-=NO↑+2H2O
科目:高中化学 来源: 题型:
【题目】利用太阳能光伏电池电解水获得H2,工作示意图如图。下列分析不正确的是( )
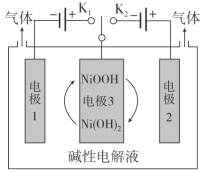
A.控制开关连接K1,电极1发生反应:2H2O+2e-=H2↑+2OH-
B.控制开关连接K2,电极3附近溶液的pH减小
C.通过控制开关连接K1或K2,可交替得到H2和O2
D.电极3的主要作用是通过NiOOH和Ni(OH)2相互转化实现电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铅酸蓄电池充电时的阳极反应:PbSO4+2H2O+2e-=PbO2+4H++![]()
B.用惰性电极电解氯化铜溶液2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.少量的Mg(HCO3)2溶液加过量的Ba(OH)2溶液的离子方程式为: Mg2++2![]() +2Ba2++4OH-=2BaCO3↓+Mg(OH)2↓+2H2O
+2Ba2++4OH-=2BaCO3↓+Mg(OH)2↓+2H2O
D.HS-的水解方程式:HS-+H2OH3O++S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写正确且为加成反应的是( )
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.CH2=CH2+Br2→CH3-CHBr2
C.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
D.![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O。将12g该有机物的完全燃烧产物通过浓硫酸,浓硫酸增重14.4g,再通过碱石灰,碱石灰增重26.4g。则该有机物的分子式为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.氯水中存在平衡:Cl2+H2O![]() H++Clˉ+HClO,加入适量NaHCO3(s)后,溶液颜色变浅
H++Clˉ+HClO,加入适量NaHCO3(s)后,溶液颜色变浅
B.打开汽水瓶时有大量的气泡溢出
C.对于反应体系CO(g)+NO2(g)![]() NO(g)+CO2(g),给平衡体系增大压强可使颜色变深
NO(g)+CO2(g),给平衡体系增大压强可使颜色变深
D.对于反应2NO2(g)![]() N2O4(g)△H<0,平衡体系升高温度颜色变深
N2O4(g)△H<0,平衡体系升高温度颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年发明的。此方法具有食盐利用率高、对环境的污染少、生产成本低等优点。其制备中涉及如下两个反应:NaC1+H2O+CO2+NH3===NaHCO3↓+NH4Cl、2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)基态氯原子的电子排布式为______,C、N、O三种元素第一电离能由大到小的顺序为____。
(2)①H2O、CO2、NH3三种分子中属于V形分子的是_______。
②在常温常压下,1体积水可溶解700体积NH3、可溶解0.8体积CO2,试解释其原因:_________。
(3)Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是________(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是________。
(4)①要确定Na2CO3固体是晶体还是非晶体,最可靠的方法是_____。
②下列事实不能支持Na2CO3的晶体类型为离子晶体的是______(填字母)。
a.熔点为851℃ b.晶体中存在Na+、CO![]()
c.可溶于水 d.晶体中存在离子键,共价键
(5)钠、氧两元素可形成两种常见化合物,其中一种的晶胞如下图所示,则该氧化物的化学式为________,若晶胞参数为d pm,晶胞的密度为![]() ,则阿伏加德罗常数NA=______(用含d、ρ的代数式表示)。
,则阿伏加德罗常数NA=______(用含d、ρ的代数式表示)。
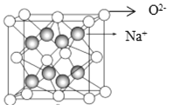
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂。工业上可先制得高铁酸钠[离子反应为Fe(OH)3+ClO-+OH-→![]() +Cl-+H2O]。然后在高铁酸钠溶液中加入一定量的KOH。可析出高铁酸钾。下列说法不正确的是( )
+Cl-+H2O]。然后在高铁酸钠溶液中加入一定量的KOH。可析出高铁酸钾。下列说法不正确的是( )
A.高铁酸钾能除去水中溶解的H2S等
B.工业上制备高铁酸钠时每生成1mol还原产物,转移3mol电子
C.高铁酸钾中Fe为+6价,具有强氧化性,能杀菌消毒
D.高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2+H2O CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
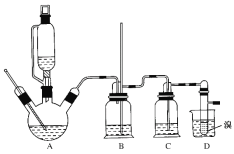
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是________。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____________。
(3)在装置C中应加入NaOH溶液,其目的是_________。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是_______。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用______洗涤除去;若产物中有少量副产物乙醚,可用_____(填操作方法名称)的方法除去。
(6)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com