
根据化学方程式:
![]()
![]()
![]()
反应起始 ![]() 皆为O,
皆为O, ![]() ,
, ![]() 后
后 ![]() ,求:
,求:
(1) ![]() 时
时 ![]() 为 ;
为 ;
(2) ![]() 时
时 ![]() 为 ;
为 ;
(3) ![]() 内
内 ![]() 平均反应速率为 ;
平均反应速率为 ;
(4) ![]() 内
内 ![]() 平均反应速率为 。
平均反应速率为 。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
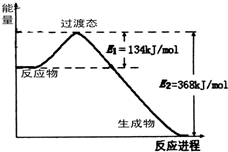 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料. 查看答案和解析>>
科目:高中化学 来源: 题型:
 2NH3,反应1mol N2时放出92.4kJ的热量,则N≡N键键能是( )
2NH3,反应1mol N2时放出92.4kJ的热量,则N≡N键键能是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com