
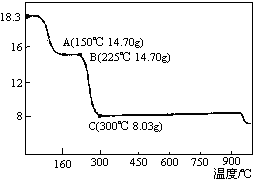
 草酸钴是制备钴的氧化物的重要原料.如图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.
草酸钴是制备钴的氧化物的重要原料.如图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.分析 (1)由图可知,CoC2O4•2H2O的质量为18.3g,其物质的量为0.1mol,Co元素质量为5.9g,C点钴氧化物质量为8.03g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:$\frac{2.13g}{16g/mol}$≈3:4,故C的Co氧化物为Co3O4;
B点对应物质的质量为14.7g,与其起始物质的质量相比减少18.3g-14.7g=3.6g,为结晶水的质量,故B点物质为CoC2O4,与氧气反应生成Co3O4与二氧化碳;
(2)由电子守恒:n(Co3+)=2 n(Cl2),由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-),联立计算n氧化物(Co2+),根据化合价电荷守恒为0计算氧化物中n(O),进而计算氧化物中n(Co):n(O).
解答 解:(1)由图可知,CoC2O4•2H2O的质量为18.3g,其我知道可为0.1mol,Co元素质量为5.9g,C点钴氧化物质量为8.03g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:$\frac{2.13g}{16g/mol}$≈3:4,故C的Co氧化物为Co3O4;
B点对应物质的质量为14.7g,与其起始物质的质量相比减少18.3g-14.7g=3.6g,为结晶水的质量,故B点物质为CoC2O4,与氧气反应生成Co3O4与二氧化碳,反应方程式为:3CoC2O4+2O2$\frac{\underline{\;\;△\;\;}}{\;}$Co3O4+6CO2,
故答案为:Co3O4;3CoC2O4+2O2$\frac{\underline{\;\;△\;\;}}{\;}$Co3O4+6CO2;
(2)由电子守恒:n(Co3+)=2 n(Cl2)=2×$\frac{4.48L}{22.4L/mol}$=0.4 mol,
由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×( 0.48L×5mol/L-2×$\frac{4.48L}{22.4L/mol}$)=1 mol,所以固体中的n(Co2+)=1mol-0.4mol=0.6 mol,
根据化合价电荷守恒为0,氧化物中n(O)=(0.6mol×2+0.4mol×3)÷2=1.2mol,
故该钴氧化物中n(Co):n(O)=1mol:1.2mol=5:6,
故答案为:5:6.
点评 本题考查化学反应图象的有关进行计算,关键是根据质量分析各点物质的成分,(2)中注意利用守恒法计算,避免计算繁琐,需要学生具备知识的基础,难度中等.


科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 操作或现象 |
| A | 制备无水FeCl3 | 将FeCl3溶液加热蒸干 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 证明非金属性Cl>C>Si | 向碳酸钠溶液中加盐酸产生气体,将气体先通过饱和NaHCO3溶液,再通入硅酸钠溶液时产生白色沉淀 |
| D | 测定NaCl中混有Na2CO3的量 | 取一定量样品加入足量稀硫酸,将产生的气体直接用足量碱石灰吸收,测得其增重,便可求得原样品中Na2CO3的量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H2>△H3>2△H1 | C. | △H2>△H1>△H3 | D. | △H3>△H2>2△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或 最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 | +1 |
| A. | 元素②⑥形成的化合物具有两性 | |
| B. | 元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 | |
| C. | 元素⑤对应的离子半径大于元素⑦对应的离子半径 | |
| D. | 元素④的最高价氧化物的水化物比元素⑤的最高价氧化物的水化物酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
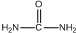 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式 +2CH3OH$→_{△}^{催化剂}$CH3OCOOCH3+2NH3↑.
+2CH3OH$→_{△}^{催化剂}$CH3OCOOCH3+2NH3↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 400 | 500 | 800 | 1 000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com