
����Ŀ����1����ҵ�ϳ�����Ϊԭ���Ʊ����ᣬ������һ���dz���Ҫ�ķ�ӦΪ
4NH3+5O2![]() 4NO+6H2O���÷�Ӧ��������Ϊ______����ԭ��Ϊ______���õ����ŷ���ʾ��������ԭ��Ӧ����ת�Ƶķ������Ŀ____________________________________��
4NO+6H2O���÷�Ӧ��������Ϊ______����ԭ��Ϊ______���õ����ŷ���ʾ��������ԭ��Ӧ����ת�Ƶķ������Ŀ____________________________________��
���б�״����VL������ȫ��Ӧ����ת��n�����ӣ���٤��������NA���ɱ�ʾΪ__________________��д����n��V�ı���ʽ����
��2��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ5�����ʣ�S�� H2S��HNO3��NO��H2O����֪������һ�ַ�Ӧ��÷�Ӧ�л�ԭ������________������Ӧ��ת����0.3mol���ӣ������������������_____g��
��3����Ҫ����գ�
����ȥ̼��������Һ�е�̼����______________________�������ӷ���ʽ��ʾԭ������
����ȥ̼������Һ�е�̼�����ƣ�Ӧ���Լ�Ϊ________________��
��������������ȥ������Һ�е������__________________�������ӷ���ʽ��ʾԭ������
���𰸡�O2 NH3 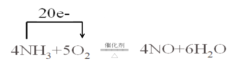 4.48n/Vmol-1 NO 4.8g CO32-+ H2O+ CO2 = 2HCO3- ����������������Һ Al3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4�� + 2H2O
4.48n/Vmol-1 NO 4.8g CO32-+ H2O+ CO2 = 2HCO3- ����������������Һ Al3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4�� + 2H2O
��������
��Ӧ��NԪ�ػ��ϼ���-3�����ߵ�+2�ۣ�OԪ�ػ��ϼ���0�۽��͵�-2�ۣ���ϻ��ϼ۵ı仯�����⡣NԪ�ػ��ϼ���-3�����ߵ�+2�ۣ�1mol������Ӧ��ת��5mol��������2������������ԭ��Ӧ���ɣ�������һ�ַ�Ӧ���NO����������NԪ�ػ��ϼ۽���������Ԫ�ػ��ϼ����ߣ�������Ӧ��H2S![]() S����Ӧ����ʽ��
S����Ӧ����ʽ��![]() ����3����ͨ�������̼���Գ�ȥ̼��������Һ�е�̼��������̼���������������Ʒ�Ӧ����̼���ƺ�ˮ����������������ȥ������Һ�����������Ҫ�������������������ʵ�����Ϊ1:2��
����3����ͨ�������̼���Գ�ȥ̼��������Һ�е�̼��������̼���������������Ʒ�Ӧ����̼���ƺ�ˮ����������������ȥ������Һ�����������Ҫ�������������������ʵ�����Ϊ1:2��
��Ӧ��NԪ�ػ��ϼ���-3�����ߵ�+2�ۣ�OԪ�ػ��ϼ���0�۽��͵�-2�ۣ���Ӧ��O2Ϊ��������NH3Ϊ��ԭ���������ŷ���ʾ�÷�Ӧ����ת�Ƶķ������ĿΪ ����״����VL���������ʵ�����
����״����VL���������ʵ�����![]() ��NԪ�ػ��ϼ���-3�����ߵ�+2�ۣ�1mol������Ӧ��ת��5mol���ӣ���
��NԪ�ػ��ϼ���-3�����ߵ�+2�ۣ�1mol������Ӧ��ת��5mol���ӣ���![]() ��NA =4.48n/Vmol-1����2������������ԭ��Ӧ���ɣ�������һ�ַ�Ӧ���NO����������NԪ�ػ��ϼ۽��ͣ�����NO�ǻ�ԭ�����Ԫ�ػ��ϼ����ߣ�������Ӧ��H2S
��NA =4.48n/Vmol-1����2������������ԭ��Ӧ���ɣ�������һ�ַ�Ӧ���NO����������NԪ�ػ��ϼ۽��ͣ�����NO�ǻ�ԭ�����Ԫ�ػ��ϼ����ߣ�������Ӧ��H2S![]() S�������������������ݷ�Ӧ����ʽ
S�������������������ݷ�Ӧ����ʽ![]() ��ת��6mol����������3molS����ת��0.3mol���ӣ�����0.15mol S�����������4.8g����3����ͨ�������̼���Գ�ȥ̼��������Һ�е�̼��������Ӧ�����ӷ���ʽ��CO32-+ H2O+ CO2 = 2HCO3-����̼���������������Ʒ�Ӧ����̼���ƺ�ˮ���������ƿ��Գ�ȥ̼������Һ�е�̼����������������������ȥ������Һ�����������Ҫ�������������������ʵ�����Ϊ1:2����Ӧ���ӷ���ʽ��Al3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4�� + 2H2O��
��ת��6mol����������3molS����ת��0.3mol���ӣ�����0.15mol S�����������4.8g����3����ͨ�������̼���Գ�ȥ̼��������Һ�е�̼��������Ӧ�����ӷ���ʽ��CO32-+ H2O+ CO2 = 2HCO3-����̼���������������Ʒ�Ӧ����̼���ƺ�ˮ���������ƿ��Գ�ȥ̼������Һ�е�̼����������������������ȥ������Һ�����������Ҫ�������������������ʵ�����Ϊ1:2����Ӧ���ӷ���ʽ��Al3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4�� + 2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ������������ֻ����Na+��K+��Ca2+��Cl����NO3�� �� ��֪����K+��Ca2+��Na+��NO3����Ũ�Ⱦ�Ϊ0.1mol/L����Cl�� ���ʵ���Ũ��Ϊ��������
A.0.1 molL��1
B.0.3 molL��1
C.0.2 molL��1
D.0.4 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���M �п������ã���ϳ�·������ͼ��ʾ��

��֪����![]()
��
��
��1��M�ķ���ʽ��______________��A�Ļ�ѧ������__________________��
��2��G�Ľṹ��ʽ��___________��F�к��������ŵ�������_______________��
��3����A����B����G����H �ķ�Ӧ���ͷֱ���___________��____________��
��4����C����D �Ļ�ѧ����ʽ��_________________��
��5��E ��ͬ���칹���У��������������Ľṹ����___________�֡�
�ٱ��Ķ�Ԫȡ���� ����E ������ͬ�Ĺ����� ���ܷ���������Ӧ��ˮ�ⷴӦ
��6����������Ϣ���Լױ�Ϊԭ���Ʊ�������![]() ����ƺϳ�·�ߣ������Լ���ѡ���� _________
����ƺϳ�·�ߣ������Լ���ѡ���� _________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(N2H4)���ǵ�Ԫ�ص���Ҫ�⻯��ڹ�ũҵ�������������й㷺Ӧ�á�
��1����ҵ�г������·�Ӧ�ϳɰ���N2+3H2![]() 2NH3 ��H��0��ijʵ������������ͬ�������ܱ������У��ֱ����Ũ�Ⱦ�Ϊc��N2��=0.100mol/L��c��H2��=0.300mol/L���з�Ӧʱ��N2��Ũ����ʱ��ı仯����ͼ�١��ڡ���������ʾ��
2NH3 ��H��0��ijʵ������������ͬ�������ܱ������У��ֱ����Ũ�Ⱦ�Ϊc��N2��=0.100mol/L��c��H2��=0.300mol/L���з�Ӧʱ��N2��Ũ����ʱ��ı仯����ͼ�١��ڡ���������ʾ��
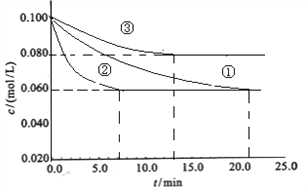
װ�D�۽���һ����Ӧ������ٲ�ͬ��������Ϊ_______________��ʵ���ƽ��ʱH2��ת����Ϊ_____________��
��2������һ�־���ǿ��ԭ�Ե���ɫ��״Һ�壬������ȼ�ϡ�
���ڻ���ƽ�����װ����(N2H4)��Һ̬H2O2����֪0.4molҺ̬N2H4������Һ̬H2O2��Ӧ��������̬N2����̬H2O���ų�256.6kJ���������÷�Ӧ���Ȼ�ѧ����ʽΪ_____________________________________________________��
����(N2H4)-����ȼ�ϵ����һ�ֻ����ͼ���ȼ�ϵ�أ��������Һ��20%-30%��KOH��Һ����֪����101kPa��25�������µ�ȼ����Ϊ624kJ��mol-1�������ȼ�ϵ�ص�����ת����Ϊ50%�������Ŀ���2.24L��������Ϊ��״���������ʱ����˵�ز����ĵ���ԼΪ_________kJ��������������������������Ϊ20%������ΪҺ̬ˮ��

��3�����ֳơ���������Ϊ��Ԫ�����ˮ�еĵ��뷽��ʽ�백���ƣ��µ�һ�����뷴Ӧ��ƽ�ⳣ��ֵΪ____________.����֪��N2H4+H+![]() N2H5+ ��K=8.7��107��KW =1.0��10-14��
N2H5+ ��K=8.7��107��KW =1.0��10-14��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�������������ȷ����
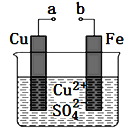
A. a��b������ʱ����Ƭ�ϻ��н���ͭ����
B. a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪ��Cu2����2e����Cu
C. ����a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ����ɫ���dz��ɫ
D. a��b��������ԭ��أ�������a����b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ҫ�л��ϳ��м���X�Ľṹ��ͼ��ʾ���йظ����ʵ�˵����ȷ����

A. X����������̼ԭ��һ������
B. X����ʹ��ˮ������KMnO4��ɫ����ԭ������ͬ
C. �����1 molX�ֱ������Na��NaHCO3��Ӧ���������������ͬ
D. X������ᣨ![]() ����Ϊͬ���칹��
����Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������KI��NaBr�Ļ����Һ��ͨ�������Cl2��ַ�Ӧ������Һ���ɲ����գ����ʣ��Ĺ��������ǣ�������
A.KI��NaBr
B.KCl��NaCl
C.KCl��NaBr
D.KCl��NaCl��I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ�÷�̪Ϊָʾ������ɲⶨ���ƫ�ߵ�ԭ�������
A. ���Ʊ���Һ��NaOH�л���Na2CO3 ����
B. ʢװ����Һ����ƿ������ˮϴ����û���ô���Һϴ
C. �ζ����յ����ʱ�����ӿ̶���
D. �ζ����յ����ʱ���ζ��ܼ��촦������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V1mL1.00mol��L-1HCl��Һ��V2mLδ��Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ(ʵ����ʼ�ձ���V1+V2=50mL)������������ȷ���ǣ� ��

A. ����ʵ��ʱ�����¶�Ϊ22�� B. ��ʵ�������ѧ�ܿ���ת��Ϊ����
C. NaOH��Һ��Ũ��ԼΪ1.00mol��L-1 D. ��ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com