
【题目】下列叙述不正确的是
A.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.甲烷、乙醇、乙酸、乙酸乙酯都能发生取代反应
D.乙烯和苯都能使溴水褪色,且褪色的原因相同
科目:高中化学 来源: 题型:
【题目】(1)如图所示,是原电池的装置图。请回答:

若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为______;电子的移动方向是______________;反应进行一段时间后溶液C的氢离子浓度将________(填“升高”、“降低”或“基本不变”)。
(2)下图是一个双液原电池装置图,下列说法正确的是__________。

A.盐桥中的阴离子向CuSO4溶液中移动 B.盐桥的作用之一是平衡电荷
C.铜片作电池的负极 D.该电池比单液原电池的电流更稳定
(3)甲醇是重要的化工原料,又可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
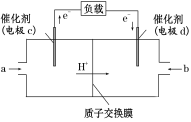
电池总反应为2CH3OH+3O2===2CO2+4H2O,则C电极是________(填“正极”或“负极”),C电极的反应方程式为_______________;若线路中转移3 mol电子,则上述CH3OH燃料电池,消耗的CH3OH的质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是__________ (填“较低温度”、“ 较高温度”或“任何温度”)
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,250℃时反应的平衡常数K=______;若要进一步提高甲醇体积分数。可采取的措施有_________________。
(6)下图是电解Na2CO3溶液的装置图。

阴极的电极反应式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

A. 500 mL 2.0 mol·L-1HCl溶液和500 mL 2.0 mol·L-1NaOH溶液的反应符合图(a),且放出热量为ΔE1
B. 500 mL 2.0 mol·L-1H2SO4溶液和500 mL 2.0 mol·L-1Ba(OH)2溶液的反应符合图(b),且吸收热量为ΔE2
C. 发生图(a)能量变化的任何反应,一定不需要加热即可发生
D. CaO、浓硫酸分别溶于水时的能量变化均符合图(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ的热量,反应方程式是2H2(g)+O2(g)===2H2O(l)。请回答下列问题:
(1)①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是_________________ 。
(3)已知下列反应的热化学方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1
②2H2(g)+O2(g)===2H2O(g) ΔH2
③C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )

A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

图1
(1)写出下列物质的官能团名称:
B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

甲 乙 丙 丁
图2
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A Na2O2 B KCl C Na2CO3 D MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学校某教师为了让学生观察到明显的实验现象,将教材铜锌单池原电池改为如图所示的双池电池。下列说法不正确的是

A. 铜电极是正极发生还原反应
B. 电池工作过程中甲池中 c(Zn2+)几乎不变
C. 装置中发生的总反应是 Cu2+ + Zn = Cu + Zn2+
D. 电子从锌电极经溶液流向铜电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室采用氧气氧化液态PCl3法制取POCl3,有关物质的部分性质如下表
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0(易挥发) | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POC13 | 2.0 | 106.0 | 153.5 |
实验装置(加热及夹持仪器略)如下:

(1)甲装置的名称是____________,干燥管的作用是____________
(2)装置C中生成POCl3的化学方程式为______________
(3)装置B的作用除观察气体的流速外,还有________ 、________
(4)反应温度不能过高,原因是______________。
(5)反应一段时间后,待三颈瓶中的液体冷却至室温,准确称取29.1g产品(仅含PCl3杂质),置于盛有60.00 mL蒸馏水的密闭水解瓶中摇动至完全与水反应,将水解液配成100.00 mL溶液,加入AgNO3溶液至恰好完全反应,测得生成的AgCl的质量为86.1g,则产品中POC13的质量分数为___(保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com