
【题目】现有CH4、C2H4、C2H6三种有机物。
(1)等质量的以上三种物质完全燃烧时耗O2的量最多的是______;生成的CO2的量最多的是______;
(2)同状况,同体积的以上三种物质完全燃烧时消耗的O2的量最多的是______;
(3)在120℃,1.01×105 Pa时,以上有机物中的两种和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是______。
【答案】CH4 C2H4 C2H6 CH4、C2H4
【解析】
(1)等质量的烃,含氢量越多,燃烧时耗氧量越多;(2)等物质的量的烃完全燃烧消耗氧气的量取决于C和H原子数的多少;
(3)根据烃燃烧的通式,CxHy+(![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O,在120℃,水为气态,反应前后的体积
H2O,在120℃,水为气态,反应前后的体积![]() ,△V=0,则y=4。烃中含有4个H原子。
,△V=0,则y=4。烃中含有4个H原子。
(1)12gC,完全燃烧需要1molO2,12gH,完全燃烧需要3molO2,则相同质量的情况下,H的质量分数越大,耗氧量越大。烃的通式CxHy,y/x越大,H的质量分数越高,耗氧量越大。CH4、C2H4、C2H6中,甲烷中y/x的值最大,H的质量分数最高,耗氧量最多的为甲烷。生成CO2最多,则含C量最高,CH4、C2H4、C2H6中,C2H4中y/x最小,含氢量最少,含碳量最高,生成的CO2最多;
(2) 同状况,同体积,则具有相同的物质的量。烃CxHy的燃烧通式,CxHy+(![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O;
H2O;![]() 越大,耗氧量越大。CH4、C2H4、C2H6中,C2H6的
越大,耗氧量越大。CH4、C2H4、C2H6中,C2H6的![]() 最大,耗氧量最多;
最大,耗氧量最多;
(3) 根据烃燃烧的通式,CxHy+(![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O,在120℃,水为气态,反应前后的体积
H2O,在120℃,水为气态,反应前后的体积![]() ,△V=0,则y=4。烃中含有4个H原子。则这两种是CH4、C2H4。
,△V=0,则y=4。烃中含有4个H原子。则这两种是CH4、C2H4。


科目:高中化学 来源: 题型:
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为K1=__________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
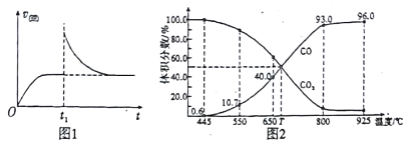
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是_________。
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如下图所示( 导电壳内部为纳米零价铁)。
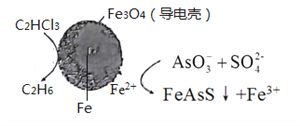
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,将1 mol A和2 mol B放入容积为5 L的某密闭容器中发生反应A(s)+2B(g)![]() C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol/L。下列叙述中错误的是
C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol/L。下列叙述中错误的是
A. 在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol/(Lmin)
B. 5 min时,容器内D的浓度为0.2 mol/L
C. 该可逆反应随着反应的进行,容器内压强逐渐增大
D. 5 min时,容器内气体总的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下不能实现的是( )
A. Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
B. Al2O3![]() NaAlO2(aq)
NaAlO2(aq) ![]() AlCl3(aq)
AlCl3(aq)
C. NH3![]() NO
NO![]() HNO3
HNO3
D. SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3
Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如下(夹持仪器已略去)。请回答以下问题。
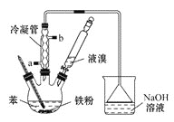
(1)制取溴苯的化学方程式是 ___________,反应过程中烧瓶内有白雾产生,是因为生成了________气体。
(2)该实验中用到冷凝管,由此猜想生成溴苯的反应属于________反应(填“放热”或“吸热”);使用冷凝管时,进水口应是______(填“a”或“b”)。
(3)该实验中将液溴全部加入苯中,充分反应后,为提纯溴苯,进行以下操作:
①将烧瓶中的液体倒入烧杯中,然后向烧杯中加入少量水,过滤,除去未反应的铁屑,过滤时必须用到的玻璃仪器是烧杯、玻璃棒、____________。
②滤液再经一系列处理,最终得到的粗溴苯中仍含有少量苯,要进一步提纯溴苯,可进行的操作是_____(填字母)。
物质 | 苯 | 溴苯 |
沸点/℃ | 80 | 156 |
水中溶解性 | 微溶 | 微溶 |
a.洗涤 b.过滤 c.蒸馏 d.结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可以是__________________。

(2)把煤作为燃料可通过下列两种途径:
途径 Ⅰ:C(s)+O2(g)===CO2(g) ΔH1<0 ①
途径 Ⅱ:先制成水煤气:C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:2CO(g)+O2(g)===2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)===2H2O(g) ΔH4<0 ④
则途径 Ⅰ 放出的热量__________(填“大于”“等于”或“小于”)途径 Ⅱ 放出的热量;ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是____________________。
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1 g甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式________________________________________________________________。
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s) ΔH=―235.8 kJ·mol―1 ①
已知:2Ag2O(s)===4Ag(s)+O2(g) ΔH=+62.2 kJ·mol―1 ②
则O3转化为O2的热化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是( )

A. 反应①、②、③都属于氧化还原反应 B. X、Y、Z、W四种元素中,Y的原子半径最小
C. Na着火时,可用甲扑灭 D. 一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B能形成离子化合物A2B,A+与B2-的电子层结构与Ne原子相同。试回答:
(1)A是元素______(写元素名称)。
(2)画出A原子结构示意图_________________。
(3)B元素在周期表中的位置为__________________。
(4)B元素与氢元素形成的化合物属于含__________键(填极性或非极性)的_________分子(填极性或非极性)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com