
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3 中混有的NaCl |
| B | BaSO4难溶于酸 | 用盐酸和BaCl2 溶液检测SO |
| C | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D | Ca(OH)2能制成 澄清石灰水 | 可配制2.0 mol·L-1 的Ca(OH)2溶液 |
科目:高中化学 来源: 题型:
下列各表述与示意图一致的是
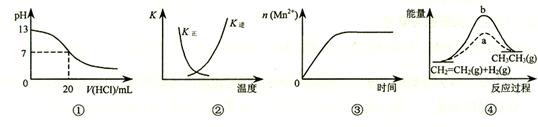
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
如图中,A、B、C、D、E是单质,G、H、I、F是B、
C、D、E分别和A形成的二元化合物,已知:
①反应C+G  B+H能放出大量的热,
B+H能放出大量的热,
G是红综色固体粉末;
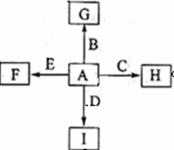
②I是一种常见的温室气体,它和E可以发生反应:
2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
⑴ ①中反应的化学方程式为
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉 克
(3) C与过量NaOH溶液反应的离子方程式为 ,
反应后的溶液与过量的化合物I反应的离子方程式为
(4) E与I反应的化学方程式为
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
查看答案和解析>>
科目:高中化学 来源: 题型:
能用H++OH- = H2O表示的是 ( )
A.Ba(OH)2溶液和稀H2SO4的反应 B.NaOH溶液和盐酸反应
C.Cu(OH)2和稀H2SO4的反应 D.NaOH溶液和CO2的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出此化学反应方程式,并用双线桥标出电子转移的方向和数目:
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,
化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期、第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_______________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为___________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为____________________,阴极上观察到的现象是____________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________________________,这样做的主要缺点是____________________。
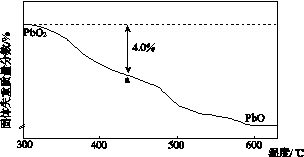
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即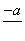 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2.3350g样品,配制成100.00mL溶液A;②准确量取25.00 mL 溶液A,用0.04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液31.25mL;③另取25.00 mL溶液A,加足量的NaOH溶液并充分加热,生成NH3 56.00mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将 (填“偏高”、或“偏低”或“ 不变”)。
不变”)。
(2)氨气常用 检验,现象是 。
 (3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
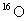 和
和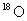 是氧元素的两种核素,
是氧元素的两种核素, 表示阿伏伽德罗常数,下列说法正确的是
表示阿伏伽德罗常数,下列说法正确的是
A.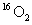 与
与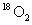 互为同分异构体
互为同分异构体
B. 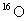 与
与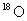 核外电子排布方式不同
核外电子排布方式不同
C.通过化学变化可以实现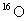 与
与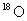 间的相互转化
间的相互转化
D.标准状况下,1.12L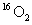 和1.12L
和1.12L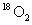 均含有0.1
均含有0.1 个氧原子
个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列说法正确的是
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.2g氢气所含原子数目为NA
C.在常温常压下,11.2L氮气所含的原子数为NA
D.17g氨气所含电子数目为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com