
下列有关原电池的说法中,正确的是( )
| A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极 |
| B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极 |
| C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| D.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质 |
B
解析试题分析:A.铝片和镁片用导线连接后插入NaOH溶液中,由于Al能够与NaOH反应,而Mg不反应,所以Al片作负极。错误。B.铝片和铜片用导线连接后插入浓硝酸中,由于Al在常温下在浓硝酸中会发生钝化现象,所以铜作负极。正确。C.镀锌铁镀层破损后,由于活动性Zn>Fe,所以Zn作原电池的负极,首先被腐蚀,仍然对Fe起到保护作用;而镀锡铁的镀层破损后,由于活动性Fe>Sn,所以Fe最原电池的负极,首先被腐蚀,Fe腐蚀的比前者快。错误。D.若将反应2Fe3++Fe=3Fe2+设计为原电池,则可用铁片作负极,石墨作正极,FeCl3溶液作电解质。错误。
考点:考查原电池的电极材料的选择及金属的腐蚀的快慢半径的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法不正确的是( )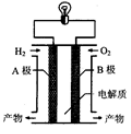
| A.A电极是负极 |
| B.外电路中电子由B电极通过导线流向A电极 |
| C.产物为无污染的水,属于环境友好电池 |
| D.该电池的总反应:2H2+O2===2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
全钒流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置, 其原理如图所示,其中H+的作用是参与正极反应,并通过交换膜定向移动使右槽溶液保持电中性。下列有关说法不正确的是( )
| A.放电时当左槽溶液逐渐由黄变蓝,其电极反应式为:VO2+ +e一+2H+=VO2+ +H2O |
| B.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为l.0mol |
| C.充电时,H+由左槽定向移动到右槽 |
| D.充电过程中,右槽溶液颜色逐渐由绿色变为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )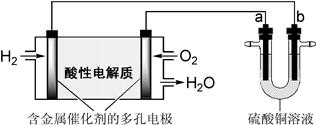
| A.燃料电池工作时,正极反应为:O2+ 2H2O + 4e- ="==" 4OH- |
| B.若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
| D.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在水中加入等物质的量的Ag+、Pb2+、Na+、SO42-、NO3-、Cl-,该溶液放在用惰性电极材料做电极的电解槽中,通电片刻,则氧化产物与还原产物质质量比为…( )
| A.35.5:108 | B.16:207 | C.8:1 | D.108:35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中正确的是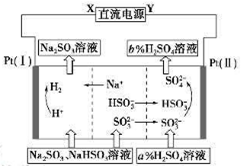
| A.X为直流电源的正极,Y为直流电源的负极 |
| B.阳极区pH减小 |
| C.图中的b<a |
| D.阴极的电极反应为HSO3——2e—+H2O=SO42—+3H+和 SO32——2e—+2H2O=SO42—+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某原电池总反应离子方程式为2Fe3++Fe===3Fe2+,能实现该反应的原电池是( )
| A.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 |
| B.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )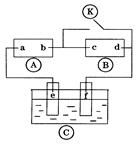
| A.a为直流电源的负极 | B.d极发生的反应为2H++2e-=H2↑ |
| C.f电极为锌板 | D.e极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用惰性电极电解400 mL一定浓度的硫酸铜溶液(不考虑电解过程中溶液体积的变化),通电一段时间后,如果向所得的溶液中加入0.05 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和体积(不考虑CO2的溶解),电解过程中转移的电子物质的量为( )
| A.0.2 mol | B.0.3mol |
| C.0.4 mol | D.0.6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com