
【题目】如图,a、b是两根碳棒.以下叙述正确的是( ) 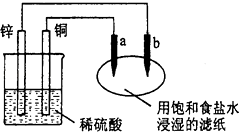
A.a是阴极,发生还原反应
B.b是负极,发生氧化反应
C.滴加酚酞试液,b极附近溶液颜色变红
D.铜片上的电极反应式是:Cu2++2e→Cu
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
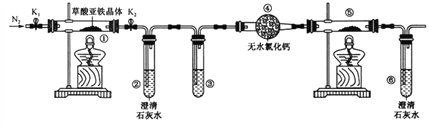
下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 实验时只需要在装置①中反应结束后再通入N2
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298 K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在不同浓度时的化学反应速率如表所示,由此可推知第5组实验中c(HI)、c(H2O2)不可能为
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
c(HI)/(mol·L-1) | 0.100 | 0.200 | 0.150 | 0.100 | ? | 0.500 |
c(H2O2)/(mol·L-1) | 0.100 | 0.100 | 0.150 | 0.200 | ? | 0.400 |
v/(mol·L-1·s-1) | 0.007 60 | 0.015 2 | 0.017 1 | 0.015 2 | 0.022 8 | 0.152 |
A. 0.150 mol·L-1、0.200 mol·L-1
B. 0.300 mol·L-1、0.100 mol·L-1
C. 0.200 mol·L-1、0.200 mol·L-1
D. 0.100 mol·L-1、0.300 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定量的硫酸铜溶液,实验装置如下图甲。电解过程中的实验数据如下图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体 积(标准状况)。则下列说法不正确的是
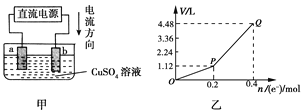
A. 电解过程中,a电极表面先有红色物质析出,后有气泡产生
B. b电极上发生反应的方程式为:4OH--4e-=2H2O+O2↑
C. 曲线O~P段表示O2的体积变化
D. 从开始到Q点时收集到的混合气体的平均摩尔质量为12 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对原子结构的认识经历了一个不断深入的过程,以下科学家以及他们提出的原子结构学说(或模型)对应关系正确的是 ( )
A.道尔顿——电子轨道理论B.卢瑟福——量子力学模型
C.玻尔——行星绕太阳模型D.汤姆逊——葡萄干面包模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 常温常压下28g N2所含电子数为10NA
B. 46g 钠充分燃烧时转移电子数为2NA
C. 0.1mol/L NH4Cl溶液中NH4+离子数小于0.1NA
D. 密闭容器中3mol NO与1molO2充分反应,剩余气体的分子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为
2AgNO3+4KOH+K2S2O8![]() Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式: .
(3)准确称取上述制备的样品(设仅含Ag2O2和Ag2O) 2.558g,在一定的条件下完全分解为Ag 和O2,得到224.0mLO2(标准状况下).计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)①常温下,.某溶液中由水电离出的c(OH﹣)=1.0×10﹣10mol/L,该溶液可以是 . (填选项)
A.pH=4的CH3COOH
B.pH=10的NaOH
C.pH=9的 Na2CO3
D.pH=2的 H2SO4
E.pH=4的 NH4Cl
(2)在100℃时,将 100mL 0.1mol/L 的稀H2SO4溶液与 100mL 0.4mol/L的NaOH 溶液混合后,溶液的pH= . (混合时溶液体积变化忽略不计,己知Kw=10﹣12).
(3)常温下,amL0.1mol/L盐酸与bmL0.1mol/L氨水混合,充分反应,若混合后溶液呈中性,则ab (填“<”、“>”或“=”).
(4)常温下,amLpH=3的盐酸与bmLpH=11的氨水混合,充分反应,若a=b,则反应后溶液中离子浓度从大到小的顺序是 .
(5)氯化铝水溶液呈酸性,原因是(用离子方程式表示>: . 把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(6)25℃,在0.10mol/LH2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如下图(忽略溶液体积的变化、H2S的挥发). ①pH=13时,溶液中的 c(H2S)+c(HS﹣)=mol/L.
②某溶液含 0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=时,Mn2+开始沉淀.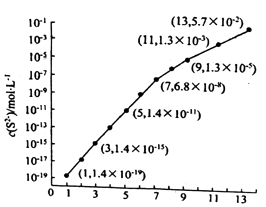
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com