
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价层电子排布式为________;高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:______________________________________________。
(2)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是___________________________。
(3)GaCl3和AsF3的立体构型分别是____________,____________。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______________。
②[B(OH)4]-的结构式为________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
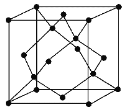
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是________________(用化学式表示);
②金刚石的晶胞参数为a pm(1 pm=10-12 m)。 1cm3晶体的平均质量为______________(只要求列算式,阿伏加德罗常数为NA)。
【答案】3d10 Cu2O中Cu+的价层电子排布处于稳定的全充满状态 水分子间存在氢键、H2Se分子间无氢键 平面三角形 三角锥型 sp3 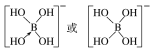 C>SiC>Si
C>SiC>Si ![]()
【解析】
(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理书写Cu+基态核外电子排布式,轨道处于全空、半满或全满时最稳定;(2)H2O的分子间存在氢键;(3)根据价层电子对互斥理论来确定其空间构型;(4)在[B(OH)4]-中B原子与4个羟基相连,一对孤对电子对。
(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理知Cu+基态核外电子排布式1s22s22p63s23p63d10或[Ar]3d10 ,则基态亚铜离子(Cu+)的价层电子排布式为3d10;原子轨道处于全空、半满或全满时最稳定,结构上Cu2+为3d9,而Cu+为3d10全充满更稳定,故高温下CuO容易转化为Cu2O;(2)H2O和H2Se都是极性分子,其分子间有色散力、诱导力、取向力。但由于H2O的分子间还有氢键存在,所以H2O沸点比H2Se沸点高;(3)GaCl3中价层电子对个数=3+![]() (3-3×1)=3,且没有孤电子对,所以其空间构型是平面三角形结构;AsF3中价电子对个数=3+
(3-3×1)=3,且没有孤电子对,所以其空间构型是平面三角形结构;AsF3中价电子对个数=3+![]() (5-3×1)=4,有一个孤电子对,所以其空间构型是三角锥形;(4)①在[B(OH)4]-中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,B原子与4个羟基相连,一对孤对电子对,为sp3杂化;②[B(OH)4]-离子中的配位键,氧元素提供孤对电子给硼元素O→B,可表示为
(5-3×1)=4,有一个孤电子对,所以其空间构型是三角锥形;(4)①在[B(OH)4]-中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,B原子与4个羟基相连,一对孤对电子对,为sp3杂化;②[B(OH)4]-离子中的配位键,氧元素提供孤对电子给硼元素O→B,可表示为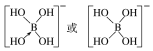 ;(5)①金刚石、晶体硅、碳化硅都是原子晶体,半径越小,熔点越高,故金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是C>SiC>Si;②根据分摊原则,立方氮化硼晶体的结构与金刚石相似,晶胞中共有8个原子,N和B各占4个。1cm3晶体的平均质量为
;(5)①金刚石、晶体硅、碳化硅都是原子晶体,半径越小,熔点越高,故金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是C>SiC>Si;②根据分摊原则,立方氮化硼晶体的结构与金刚石相似,晶胞中共有8个原子,N和B各占4个。1cm3晶体的平均质量为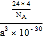 =
=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子反应中,属于氧化还原反应的是
A.Cu2++2OH-= Cu(OH)2↓B.H++OH- =H2O
C.2H++CO32-=H2O+CO2↑D.Cu2++Fe=Fe2++ Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(CH3OCOOCH3,简称 DMC)是一种应用前景广泛的新材料。在密闭容器中按n(CH3OH)∶n(CO2)=2∶1 投料直接合成 DMC,反应方程式为﹕2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g)。一定条件下, 平衡时 CO2 的转化率如图所示。下列说法中不正确的是
CH3OCOOCH3(g)+H2O(g)。一定条件下, 平衡时 CO2 的转化率如图所示。下列说法中不正确的是
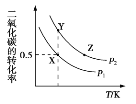
A. 该反应的正反应为放热反应
B. 压强 p2>p1
C. X 点对应的平衡常数为 0.1L/mol
D. X、Y、Z 三点对应的初始反应速率的关系为 Z> Y > X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L的密闭容器中,发生反应4A(s)+3B(g)![]() 2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 用BCD分别表示反应的速率,其比值是3∶2∶1
C. 在第2 min末的反应速率用B表示是0.3 mol·L-1·min-1
D. 在这2 min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
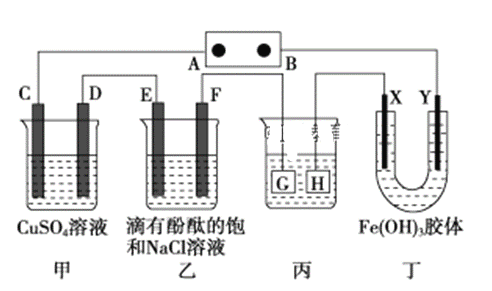
(1)B极是电源的________极,一段时间后,甲中溶液颜色________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明氢氧化铁胶体粒子带___电荷(填“正”或“负”,在电场作用下向____极移动(填“X”或“Y”)。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为_________________。
(3)现用丙装置给铜件镀银,则H应该是________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________,甲中溶液的pH________(填“变大”“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
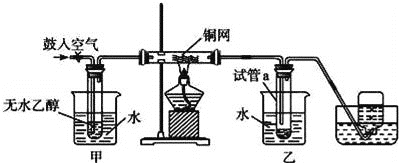
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的总化学方程式_______。
(2)甲和乙两个水浴作用不相同。甲的作用是__________,乙的作用是___________。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是__________;集气瓶中收集到的气体的主要成分是__________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有___。要除去该物质,可先在混合液中加入__________(填写字母),然后再通过蒸馏即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16.8 g Fe 跟一定量浓 HNO3 反应,Fe 全部溶解,共收集 NO、NO2 的总体积为 11.2 L(标准状况),所得溶液中 H+的物质的量为 0.02 mol,请回答:
(1)反应中被还原的硝酸为_______________mol。
(2)反应过程中转移电子数为_______________。
(3)生成的 NO 与 NO2 的物质的量之比为__________________。
(4)反应后溶液中 NO3-的物质的量为___________mol。
(5)写出该反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有丰富的化学资源,从海水中可提取多种化工原料。
以下为工业从海水中提取液溴的流程图如下,已知:溴的沸点为59 ℃,微溶于水,有毒性。

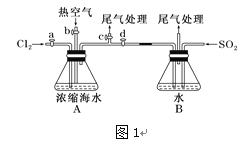
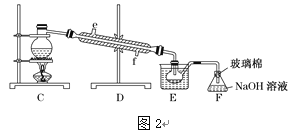
(1)某同学利用“图1”装置进行实验,当进行步骤①时,应关闭活塞___,打开活塞______。
(2)步骤③中反应的离子方程式____________________________。
(3)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是________________________。
(4)步骤⑤用“图2”装置进行蒸馏,C处蒸馏烧瓶中已加入碎瓷片,尚未安装温度计,此外装置C中还有一处,改进后效果会更好,应该如何改进_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com