
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
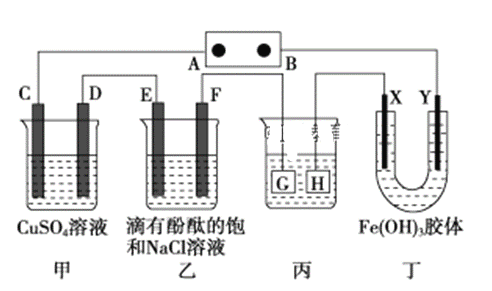
(1)B极是电源的________极,一段时间后,甲中溶液颜色________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明氢氧化铁胶体粒子带___电荷(填“正”或“负”,在电场作用下向____极移动(填“X”或“Y”)。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为_________________。
(3)现用丙装置给铜件镀银,则H应该是________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________,甲中溶液的pH________(填“变大”“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是__________________________________________。
【答案】负极 逐渐变浅 正 Y 1∶2∶2∶2 镀件 AgNO3 5.4 g 变小 Fe+Cu2+![]() Cu+Fe2+
Cu+Fe2+
【解析】
将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F极是阴极,B为电源负极、A为电源正极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极。
(1)B电极是电源的负极,C、D、E、F电极发生的电极反应分别为:2H2O-4e-=O2+4H+、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-、2H++2e-═H2↑,Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷。(2)C、D、E、F电极发生的电极反应分别为:2H2O-4e-=O2+4H+、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-、2H++2e-═H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2。电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,电镀液含有镀层金属阳离子,故电镀液为AgNO3溶液;当乙中溶液的c(OH-)=0.1molL-1时(此时乙溶液体积为500mL),根据电极反应2H2O+2e-═H2↑+2OH-,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,电解硫酸铜的过程中水放电生成氧气,有硫酸生成,所以氢离子浓度增大,所以酸性增强,甲中溶液的pH变小。(4)C电极换为铁,则阳极铁失电子,阴极铜离子得电子,电解池反应为:Fe+Cu2+ ![]() Cu+Fe2+。
Cu+Fe2+。


科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是 ( )
A.制备溴苯时,将苯与溴水混合,剧烈振荡
B.除去甲烷中混有的二氧化碳时,依次通过烧碱溶液和浓硫酸
C.在酸性高锰酸钾溶液中滴加几滴苯,用力振荡,紫红色褪去
D.在苯中通氢气制备环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲容器有一个移动活塞,能使容器保持恒压。起始时向甲中充入2 mol SO2、1 mol O2,向乙中充入4mol SO2、2 mol O2。甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,.关闭活塞K,使两容器中各自发生下述反应:2 SO2(g)+O2(g)![]() 2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
A.乙容器中SO2的转化率小于60%
B.平衡时SO3的体积分数:甲>乙
C.打开K后一段时间.再次达到平衡.甲的体积为1.4 L
D.平衡后向甲中再充入2mol SO2、1mol O2和3moLSO3,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:3A(g)+B(g)===2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为①v(A)=0.6 mol·L-1·min-1
②v(B)=0.45 mol·L-1·min-1
③v(C)=0.015 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·min-1,
则此反应在不同条件下进行最快的是( )
A. ②③B. ①③C. ②④D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价层电子排布式为________;高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:______________________________________________。
(2)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是___________________________。
(3)GaCl3和AsF3的立体构型分别是____________,____________。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______________。
②[B(OH)4]-的结构式为________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
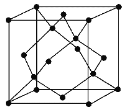
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是________________(用化学式表示);
②金刚石的晶胞参数为a pm(1 pm=10-12 m)。 1cm3晶体的平均质量为______________(只要求列算式,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图转化关系,请回答下列问题:
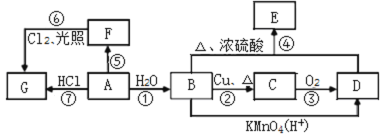
(1)写出A中官能团的名称:A________,B中官能团的电子式B________。
(2)在F的同系物中最简单的有机物的空间构型为________。
(3)写出与F互为同系物的含5个碳原子的所有同分异构体中一氯代物种类最少的物质的结构简式:___________________________________________。
(4)写出下列编号对应反应的化学方程式。
④ _____________________________;⑦ _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个密闭容器中进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g)![]() pC(g)+qD(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g)+qD(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且m+n______p+q(填“>”、“<”或“=”)。
(2)若加入催化剂,平衡时气体混合物的总物质的量________(填“增大”、“减小”或“不变”)。
(3)若B是有色物质,A、C、D均为无色物质,则加入C(体积不变)时混合物的颜色__________(填“变深”、“变浅”或“不变”),而维持容器内气体的压强不变,充入氖气时,平衡__________移动(填“向左”、“向右”、或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量均为m g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(P)与温度(T)的关系如图所示,则X、Y气体可能分别是( )
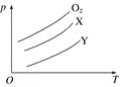
A. C2H4、CH4 B. CO2、Cl2
C. SO2、CO2 D. CH4、Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com