
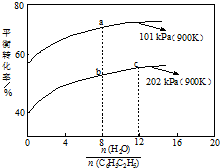
 ����ϩ��C8H8���������������ϵ���Ҫ���壬���Ʊ�ԭ���ǣ�
����ϩ��C8H8���������������ϵ���Ҫ���壬���Ʊ�ԭ���ǣ�| A�� | a��ת����Ϊ75%������ʼ��1 L���������г���1 mol �ұ�����ƽ�ⳣ��Ϊ2.25 | |
| B�� | b��ת����Ϊ50%�����������б���ϩ���������Ϊ$\frac{1}{19}$ | |
| C�� | ����ʱ����ϡ�ͼ��ܼ�СC8H10 ��g��ƽ��ת���� | |
| D�� | b���c���¶Ⱥ�ѹǿ��ͬ�����Է�Ӧ����Ҳ��� |
���� A�������ұ�����ʼŨ���Լ��ұ���Ũ�ȱ仯������������ʽ����ƽ��ʱ����ֵ����ʵ���Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻
B���ʼͶ���ұ������ʵ���Ϊ1mol������μӷ�Ӧ���ұ������ʵ�������������ʽ����ƽ��ʱ����ֵ����ʵ��������������ұ������������
C�����������£�����ϡ�ͼ�ˮ����Ӱ��ƽ���ƶ���
D����ϵ��ѹǿ����ʱ��$\frac{n��ˮ��}{n���ұ���}$Խ��Ӧ������Ũ��ԽС���൱�ڷ�Ӧ��ϵ��ѹ��
��� �⣺A������ʼ��1 L���������г���1 mol �ұ����ұ���ʼŨ��Ϊ1mol/L��ƽ��ʱ�ұ���ת����Ϊ50%�����ұ�Ũ�ȱ仯��=1mol/L��75%=0.75mol/L����
C6H5C2H5��g��?C6H5CH=CH2��g��+H2��g��
��ʼ��mol/L����1 0 0
�仯��mol/L����0.75 0.75 0.75
ƽ�⣨mol/L����0.25 0.75 0.75
��ƽ�ⳣ��=$\frac{0.75��0.75}{0.25}$=2.25����A��ȷ��
B���ʼͶ���ұ������ʵ���Ϊ1mol����ˮ���������ʵ���Ϊ8mol��b��ת����Ϊ50%����μӷ�Ӧ�ұ������ʵ���=1mol��50%=0.5mol����
C6H5C2H5��g��?C6H5CH=CH2��g��+H2��g��
��ʼ��mol����1 0 0
�仯��mol����0.5 0.5 0.5
ƽ�⣨mol����0.5 0.5 0.5
��ƽ��ʱ�����ϵ�����ʵ���=8mol+0.5mol+0.5mol+0.5mol=9.5mol���ʻ�������б���ϩ���������=$\frac{0.5mol}{9.5mol}$=$\frac{1}{19}$����B��ȷ��
C�����������£�����ϡ�ͼ�ˮ����Ӧ������Ũ�Ȳ��䣬��Ӱ��ƽ���ƶ���C6H5C2H5ƽ��ת���ʲ��䣬��C����
D����ϵ��ѹǿ����ʱ��c��$\frac{n��ˮ��}{n���ұ���}$ֵ��b���c�㷴Ӧ������Ũ��ԽС���൱�ڷ�Ӧ��ϵ��ѹ��c�㷴Ӧ���ʱ�bС����D����
��ѡAB��
���� ���⿼�黯ѧƽ�⼰ƽ�ⳣ�����㡢��ѧƽ��ͼ��ȣ�Ϊ��Ƶ���㣬������ѧ���ķ��������������Ŀ��飬ע���ѹ�����¼���ϡ�ͼ���ʹ��Ӧ�ĸ�������ռ�ķ�ѹ���ͣ�Ũ�Ƚ��ͣ���Ϊ�״���Ŀ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K+��Na+��Cl-��NO3- | B�� | Al3+��Na+��NO3-��Cl- | ||
| C�� | K+��Na+��Cl-��AlO2- | D�� | K+��NH4+��SO42-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���������Ӽ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ
���������Ӽ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ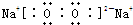 �����м��Թ��ۼ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ
�����м��Թ��ۼ��ͷǼ��Թ��ۼ��Ļ�����ĵ���ʽΪ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �淴Ӧ������������Ӧ���ʼ�С��ƽ�����淴Ӧ�����ƶ� | |
| B�� | �淴Ӧ���ʼ�С������Ӧ��������ƽ��������Ӧ�����ƶ� | |
| C�� | �����淴Ӧ���ʶ�����ƽ��������Ӧ�����ƶ� | |
| D�� | �����淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 һ�������£������Ϊ3L���ܱ������У�CO��H2��Ӧ���ɼ״���CH3OH��������ΪCu2O/ZnO����CO��g��+2H2��g��?CH3OH��g����������и��⣺
һ�������£������Ϊ3L���ܱ������У�CO��H2��Ӧ���ɼ״���CH3OH��������ΪCu2O/ZnO����CO��g��+2H2��g��?CH3OH��g����������и��⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
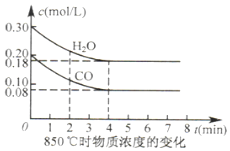 ����β�����������������ԭ��֮һ��
����β�����������������ԭ��֮һ��| ��ʼ���ʵ��� | �� | �� | �� |
| n��H2O��/mol | 0.10 | 0.20 | 0.20 |
| n��CO��/mol | 0.10 | 0.10 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
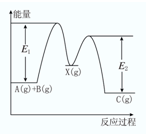 ��ӦA��g��+B��g����C��g����H�����������У���A��g��+B��g����X��g����H1����X��g����C��g����H2����Ӧ�����������仯��ͼ��ʾ��E1��ʾA��g��+B��g����X��g���Ļ�ܣ�����˵����ȷ���ǣ�������
��ӦA��g��+B��g����C��g����H�����������У���A��g��+B��g����X��g����H1����X��g����C��g����H2����Ӧ�����������仯��ͼ��ʾ��E1��ʾA��g��+B��g����X��g���Ļ�ܣ�����˵����ȷ���ǣ�������| A�� | ��H=E1-E2 | B�� | E1�Ƿ�Ӧ�ٵĻ�� | ||
| C�� | X�Ƿ�ӦA��g��+B��g����C��g���Ĵ��� | D�� | ��H2��0 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com