
 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
分析 (1)已知:①N2(g)+2O2(g)═2NO2(g)△H=+68.0kJ•mol-1,
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1,
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,
根据盖斯定律:4×③-①-2×②可得;
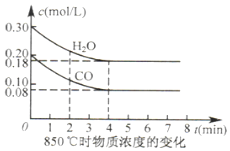
(2)从图象可知则0-4minH2O的浓度从0.3mol/L减少到0.18mol/L,根据v=$\frac{△c}{△t}$、化学平衡常数概念计算速率、K;再根据相同温度下K不变,计算甲容器中CO的转化率;增加反应物,平衡正向移动.
解答 解:(1)已知:①N2(g)+2O2(g)═2NO2(g)△H=+68.0kJ•mol-1,
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1,
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,
根据盖斯定律:4×③-①-2×②可得:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△=-1200.0kJ/mol;
故答案为:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△=-1200.0kJ/mol;
(2)850℃,根据三段式:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):0.2 0.3 0 0
转化(mol/L):0.12 0.12 0.12 0.12
平衡(mol/L):0.08 0.18 0.12 0.12
则v(H2O)=$\frac{0.12mol/L}{4min}$=0.03mol•L-1•min-1,K=$\frac{0.12×0.12}{0.08×0.18}$=1;
850℃,设CO的转化率为x,甲容器中有:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):0.1 0.1 0 0
转化(mol/L):0.1x 0.1x 0.1x 0.1x
平衡(mol/L):0.1-0.1x 0.1-0.1x 0.1x 0.1x
温度不变,K不变,则有K=$\frac{0.1x×0.1x}{(0.1-0.1x)×(0.1-0.1x)}$=1,解得x=50%;乙容器相当于在甲容器平衡的基础上再加入0.1molH2O,平衡正向移动,CO的转化率增大,甲<乙;
故答案为:0.03mol•L-1•min-1; 1; 50%;<.
点评 本题考查了盖斯定律和化学平衡的影响因素和相关计算,较为基础,注意利用三段式进行计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
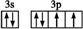 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
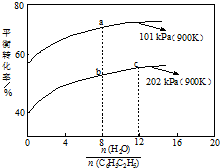 苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:
苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:| A. | a点转化率为75%,若起始向1 L恒容容器中充入1 mol 乙苯,则平衡常数为2.25 | |
| B. | b点转化率为50%,则混合气体中苯乙烯的体积分数为$\frac{1}{19}$ | |
| C. | 恒容时加入稀释剂能减小C8H10 (g)平衡转化率 | |
| D. | b点和c点温度和压强相同,所以反应速率也相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.
,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$互为同位素 | |
| B. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的质量数相同 | |
| C. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$是同一种核素 | |
| D. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的核外电子数和中子数均为62 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用过滤分离溶液和胶体 | |
| B. | 用渗析法可以除去溶液中的胶体粒子 | |
| C. | 向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 | |
| D. | 向Fe(OH)3胶体中加入足量稀盐酸后,依然有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度下,在水中的溶解度Na2CO3>NaHCO3 | |
| C. | 相同质量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3 | |
| D. | Na2CO3 和NaHCO3均可与澄清石灰水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com