
常温下,下列各组离子一定能大量共存的是
A.pH=1的溶液中:Na+、Cl-、K+、HS-
B.水电离出的c(H+) =10-12mol/L中:Ba2+、K+、Cl-、CO32-
C.c(OH-)/c(H+)=1012的水溶液中:CH3COO-、CO32-、Na+、K+
D.c(Al3+) =1mol/L的溶液中:Na+、NO3-、SO42-、HCO3-
科目:高中化学 来源: 题型:
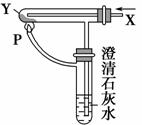
按右图装置通入X气体,并在管P处点燃,实验结果是澄清石灰水变浑浊,则X、Y可能是 ( )。
A.H2和Fe2O3
B.CO和CuO
C.H2 和Na2CO3
和Na2CO3
D.CO和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种溶液中,能大量共存的无色透明的离子组
A.PH=0的溶液:CH3COO- 、NO3-、SO42-、I-
B.C(H+)=10-14mol/L的溶液中:Na+ 、AlO2-、S2-、SO32-
C.酸性环境下:Na+、Cu2+、NO3-、SO42-、
D.pH=7的溶液中:K+ 、Na+ 、Fe3+ 、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,碳钢腐蚀与溶液pH的关系如下:
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2— |
下列说法不正确的是
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e—=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.在水中能电离出离子的化合物一定是离子化合物
B.CO2分子中含极性键,且溶于水能导电,所以CO2是电解质
C.Ca(OH)2微溶于水,所以是弱电解质
D.CH3COOH在水中只能部分电离,所以是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在含CH3COOH和CH3COONa均为0.1mol/L的溶液中,测得pH<7,则下列说法中正确的是
A.c(CH3COO-)<c(Na+) B. c(CH3COOH) + c(CH3COO-)=0.2mol/L
C.c(CH3COOH) > c(CH3COO-) D.c(CH3COO-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题
(1)甲同学运用沉淀法测定样品中NaOH的含量。甲同学选用的药品除样品外,还应有
▲ ,实验中应测定的数据有 ▲ 。
(2)乙同学运用滴定法测定样品中NaOH的含量。
①用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 ▲ 。滴定终点的现象是 ▲ 。
②下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 ▲ (填写序号)
 A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
③若滴定开始和结束时,酸式滴定管中的液面如右图所示:
开始 结束
则起始读数为 ▲ mL,终点读数 ▲ mL;
(3)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 第一次 | 20.00 | 0.00 | 26.01 | |
| 第二次 | 20.00 | 1.56 | 30.30 | |
| 第三次 | 20.00 | 0.22 | 26.21 |
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
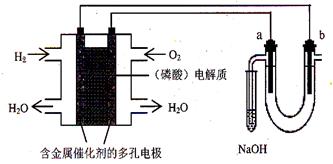
用酸性氢氧燃料电池电解饱和食盐水的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是
A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH-B.电解时,a 电极周围首先放电的是Cl—
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.2g H2 时,b极周围会产生2.24L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是 ( )。
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+===Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-===
BaCO3↓+H2O
C.向澄清石灰水中通入少量CO2:OH-+CO2===HCO3-
D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积
混合:2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com