
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作致冷剂 C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
短周期主族元素A、B、C、D、E的原子序数依次增大,其中只有C是金属元素,B是地壳中含量最多的元素,A元素常见化合价为+1和-1;A与C的最外层电子数相同,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍。下列叙述正确的是
A.元素的原子半径:A<B<C<D< E
B.对应氢化物的热稳定性:D > E
C.B与C、B与D形成的化合物中化学键类型相同
D.五种元素中最高价氧化物对应的水化物酸性最强的是E
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
条件一定时,反应2A(g)+B(g) 2C(g),B的转化率α与温度T变化关系曲线图如下所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是
2C(g),B的转化率α与温度T变化关系曲线图如下所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是

A.a B.b C.c D.d
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
| 实验操作 | 实验现象 | 结论 |
A | 淀粉与稀H2SO4共热,再加银 氨溶液水浴加热 | 无银镜生成 | 淀粉水解产物无还原性 |
B | 向某溶液中先滴加氯水,再滴 加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
C | 向NaAlO2溶液中滴加饱和NaHCO3溶液 | 有白色沉淀产生 | 验证两者都发生了水解反应,且相互促进 |
D | 将CO2通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明H2CO3酸性比H2SiO3强 |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
能正确解释下列反应原理的离子方程式是
A.用小苏打治疗胃酸过多:CO32- + 2H+ === CO2↑ + H2O
B.向明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全:
2Al3+ + 3SO42- + 3Ba2+ + 6OH- === 3BaSO4↓ + 2Al(OH)3↓
C.大理石溶于醋酸中:CaCO3 + 2H+ === Ca2+ + CO2↑ + H2O
D.稀硝酸中加入过量的铁粉:Fe + 4H+ + NO3- === Fe2+ + NO↑ + 2H2O
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:填空题
(15分)下列框图所示的转化关系中,A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见的无色液体。L焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)
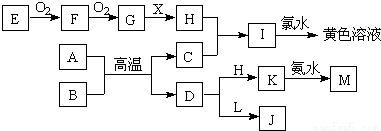
请回答以下问题:
(1)含碳量在0.03 %~2 %之间的C的合金,是目前世界上使用量最大的合金,这种合金是 ;
A.铝合金 B.青铜 C.镁合金 D.钢铁
(2)F的化学式为 ;
(3)I与氯气反应的离子方程式为 ;
(4)A与B生成C和D的反应是 (填“放出”或“吸收”)大量热量的反应;
(5)D与L反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:选择题
在离子RO42—中,共有x个核外电子,R的质量数为A,则R原子核内含有的中子数目为
A.A-x+48 B.A-x+24 C.A-x+34 D.A-x-24
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(16分)活性氧化锌在橡胶、化工、涂料、陶瓷、医药、电子等行业有着广泛的应用。但随着锌资源的不断开发和利用,锌矿资源越来越少,因此研究利用锌二次资源对缓解锌资源枯竭进程具有重要意义。下图是以含锌铜烟尘(火法炼铜的副产品,主要成分是ZnO、CuO和FeO)制备活性氧化锌的工艺流程:
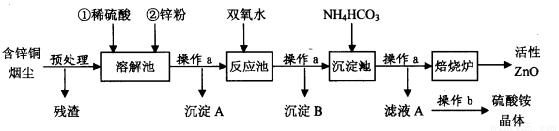
含锌铜烟尘经过预处理后的主要成分为ZnO,还含有少量的CuO和Fe2O3。
(1)操作a名称是____ ,在实验室中,该过程用到的主要玻璃仪器有 。
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:
①将Fe3+还原为Fe2+;② :③调节溶液的pH(控制其在5,0-5.4之间)。
(3)检验溶解池中Fe3+已全部被还原为Fe2+的最佳试剂是 ;
(4)右表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为
1.0 mol-l计算)。反应池中的温度控制在90-95℃,请写出反应池中所发生反应的离子方
程式: 。
| 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
2n2+ | 5.9 | 8.9 |
(5)操作b的名称是________ ;
(6)沉淀池中得到的沉淀化学式可以表示为:aZnCO3·bZn(OH)2·cH2O(a、b、c均为整数)。某校化学兴趣小组的同学为了确定其组成,进行如下实验:称取3.59g沉淀进行焙烧,将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,它们分别增重0.72g和0.44g,则该沉淀的组成为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
①N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol ②2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
③C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO的原理如图1,A为电源的 极,阴极反应式为 。
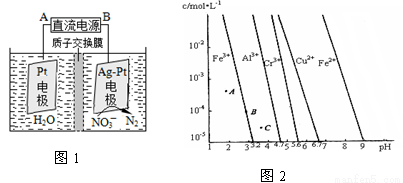
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com